
科目: 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目: 来源: 题型:
【题目】假设12C的相对原子质量为24,如果以0.024 kg12C所含的原子数为阿伏加德罗常数,下列数值中肯定不变的是( )
A.氢气的摩尔质量
B.16 g氧气所含的分子数
C.氧气的相对分子质量
D.一定条件下,跟2 g氢气相化合的氧气的物质的量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对各电解质溶液的分析正确的是( )
A.硫酸铁溶液中能大量共存的离子:K+、Na+、NO3-、CO32-
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.0.1molL﹣1Na2S溶液中存在:c(OH-)=c(H+)+c(HS﹣)+2c(H2S)
D.NH4HSO4溶液呈酸性的主要原因是:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
查看答案和解析>>
科目: 来源: 题型:
【题目】某固定容积为1L的密闭容器中,1molA(g)与1molB(g)在催化剂作用下加热到500℃发生反应:A(g)+B(g)![]() C(g)+2D(s) ΔH>0,下列有关说法正确的是
C(g)+2D(s) ΔH>0,下列有关说法正确的是
A. 升高温度,![]() 增大,
增大,![]() 逆减小
逆减小
B. 平衡后再加入1molB,上述反应的ΔH增大
C. 通入稀有气体,压强增大,平衡向正反应方向移动
D. 若B的平衡转化率为50%,则该反应的平衡常数等于2
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图象的说法正确的是
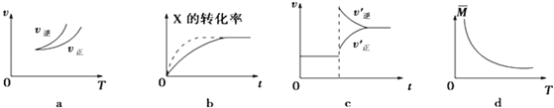
A.依据图a可判断正反应为吸热反应
B.在图b中,虚线可表示压强增大
C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如下:
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
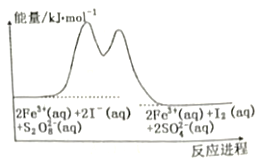
A. 化学反应速率与Fe3+浓度的大小有关
B. 该反应为吸热反应
C. Fe2+是该反应的催化剂
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
科目: 来源: 题型:
【题目】将6.5 g Zn放入5 L 0.1mol/L 的盐酸中,待Zn完全反应后,试计算:
(1)6.5 g Zn的物质的量________。
(2)生成氢气的体积________。
(3)反应后剩余HCl的物质的量________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.②③B.①③④C.①④D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中提纯Al2O3,并回收铁红。流程如下:
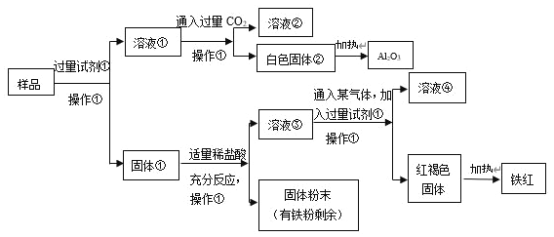
(1)操作①是_________,在实验室进行该操作需要的玻璃仪器有_________。
(2)白色固体②是_________,样品和试剂①反应的化学方程式是_________。
(3)固体①加入适量稀盐酸,可能发生的反应有:_______(用化学方程式表达)。
(4)溶液③中铁元素的存在形式是_________,如何用实验证明:____。
(5)溶液③中通入某气体,该气体可以是_________(任写一种的化学式),红褐色固体制得铁红的化学方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现用质量分数为18.4 mol/L的浓硫酸来配制 500 mL0.46 mol/L的稀硫酸,可供选择的仪器有:①玻璃棒②烧杯③胶头滴管④量筒⑤容量瓶⑥托盘天平⑦药匙
(1)上述仪器中,配制过程中用不到的有________。
(2)计算所需浓硫酸的体积为_________mL。
(3)在配制过程中,下列操作可引起所配溶液浓度偏高的有_________。(填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容时,俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com