
科目: 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)B的基态原子核外电子排布式为____________________。
(2)BF3的立体构型是_____________________;HF能与BF3化合得到HBF4,从化学键形成角度分析HF与BF3能化合的原因___________。
(3)H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4]-,H3BO3 和[B(OH)4]-中B的杂化轨道类型分别为为____________ 、____________。
(4)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_____________,其中三种元素的电负性由大到小的顺序是__________________________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O,其结构如图所示,
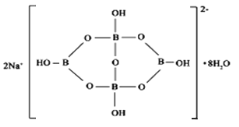
它的阴离子可形成链状结构,则该晶体中不存在的作用力是_________(填选项字母)。
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
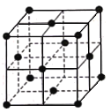
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图所示,其堆积方式为____________,Li+占据阴离子组成的所有最小正四面体中心,该化合物的化学式为____________(用最简整数比表示)。假设晶胞边长为a pm,用NA代表阿伏加德罗常数的值,则该晶胞的密度为___________g/cm3(用含a,NA的代数式表示) 。
查看答案和解析>>
科目: 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
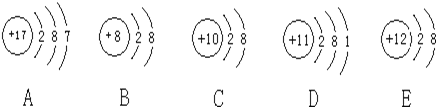
(1)属于离子结构示意图的是______、______(填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同)______,最容易失去电子的原子是______,最容易得到电子的原子是______。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式______。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号______、______。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)写出乙烯分子的电子式:________。
(2)写出(2﹣甲基﹣1,3﹣丁二烯)的结构简式_____________。
(3)立方烷 ![]() 的一氯代物有__________种,它的六氯代物有________种。
的一氯代物有__________种,它的六氯代物有________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是________;互为同分异构体的是________;属于同种物质的是________。
①O2和O3 ②1H、2H、3H ③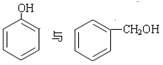 ④
④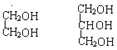 ⑤
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦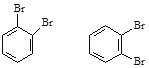
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 为核电荷数小于18的两种元素,元素
为核电荷数小于18的两种元素,元素![]() 的原子的最外层电子数是次外层电子数的一半,元素
的原子的最外层电子数是次外层电子数的一半,元素![]() 的原子的最外层电子数与最内层电子数之和等于次外层电子数。下列有关叙述正确的是
的原子的最外层电子数与最内层电子数之和等于次外层电子数。下列有关叙述正确的是
A.![]() 、
、![]() 一定是非金属元素B.
一定是非金属元素B.![]() 的最外层电子数比
的最外层电子数比![]() 的少
的少
C.![]() 的单质在化学反应中只能作还原剂D.
的单质在化学反应中只能作还原剂D.![]() 与
与![]() 的最外层电子数相等
的最外层电子数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+ ![]() O2(g) =CO2(g)+2H2O(1) △H1=akJmol-1
O2(g) =CO2(g)+2H2O(1) △H1=akJmol-1
H2(g)+![]() O2(g) =H2O(1) △H2=bkJmol-1
O2(g) =H2O(1) △H2=bkJmol-1
H2O(g) = H2O(l) △H3=ckJmol-1
则 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=__________kJmol-1
CH3OH(g)+H2O(g) △H=__________kJmol-1
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)
2CO(g) ![]() H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
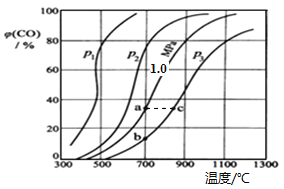
回答下列问题:
①压强p1、p2、p3的大小关系是________;Ka 、 Kb 、 Kc 为a、b、c三点对应的平衡常数,则其大小关系是_________。
②900℃、1.0 MPa时,足量碳与a molCO2反应达平衡后,CO2的转化率为___________ (保留三位有效数字),该反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)① 以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_____________; 300~400℃时,乙酸的生成速率升高的主要原因是___________。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_____________; 300~400℃时,乙酸的生成速率升高的主要原因是___________。
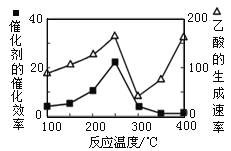
② 为了提高该反应中CO2的转化率,可以采取的措施是_____(写一条即可)。
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为___________;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_____mol硫酸。
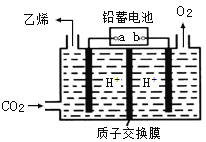
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,e、g、h、i、j均是由这些元素组成的二元化合物,i常温常压下为液体,其余均为无色气体。e的摩尔质量为g的2倍,f是元素Z的单质,g物质能使湿润的红色石蕊试纸变蓝,h的组成元素位于同一主族。上述物质的转化关系如图所示。下列说法正确的是
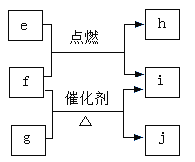
A.原子半径:Y>Z>W>XB.热稳定性:i>g, 沸点:i>e
C.Y与W的含氧酸均是强酸D.h与j均为酸性氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】12.0g某液态有机化合物A完全燃烧后,生成14.4g H2O和26.4g CO2。测得有机化合物A的蒸气对H2的相对密度是30,求:
(1)有机物A的分子式_______________________。(写出计算过程)
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρ g/cm3)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为____________(可以不化简,写出计算过程)。

(3)已知该有机物能够与金属钠或钾发生反应,并对有机物进行核磁共振操作,发现核磁共振氢谱图上有三组吸收峰,且峰面积之比为6:1:1,请写出该物质的结构简式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.1 mol·L-1 NaOH溶液逐滴滴入10 mL 0.1 mol·L-1 NH4HSO4溶液中,溶液的pH与NaOH溶液体积关系如图所示:
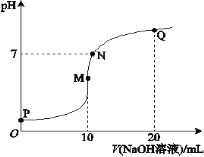
下列关系中,不正确的是
A.M点c(Na+)>c(![]() )
)
B.N点c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() -)
-)
C.Q点c(![]() )+c(NH3·H2O)=c(Na+)
)+c(NH3·H2O)=c(Na+)
D.M、N、Q三点中,水的电离程度M>N>Q
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是
A.用图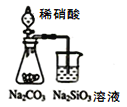 装置可证明非金属性强弱:N>C>Si
装置可证明非金属性强弱:N>C>Si
B.用图 装置可制备少量O2,其优点是能随时控制反应的发生和停止
装置可制备少量O2,其优点是能随时控制反应的发生和停止
C.用图 装置可配制100mL一定物质的量浓度的硫酸溶液
装置可配制100mL一定物质的量浓度的硫酸溶液
D.用图 装置可蒸发 NaCl溶液得到氯化钠晶体
装置可蒸发 NaCl溶液得到氯化钠晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH ]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国科学家在这一变换中利用双功能催化剂突破了低温下高转化率与高反应速率不能兼得的难题。反应历程如图所示:
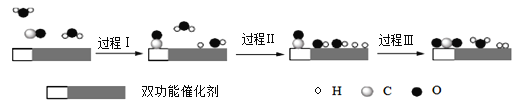
下列说法正确的是
A.低温下实现高反应速率是因为使用了双功能催化剂降低了水煤气变换反应的ΔH
B.过程Ⅰ为吸热过程、过程Ⅲ为放热过程
C.过程Ⅲ生成了具有非极性共价键的H2、CO2
D.图示中的2个H2O分子只有一个H2O分子参与了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com