
科目: 来源: 题型:
【题目】某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
(1)准确称取wg食盐,加适量蒸馏水使其完全溶解;
(2)用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;请配平反应的方程式KIO3+KI+H2SO4=K2SO4+I2+H2O;______________
(3)生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。滴定时,选择______________为指示剂,眼睛应该注视______________,达到滴定终点时的现象为______________,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全。
(4)该加碘食盐样品中的碘元素含量是______________mg/kg(以含w的代数式表示)。
(5)若记录标准液读数时,起始时仰视,终点时俯视,则所测结果会______________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图,下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________。
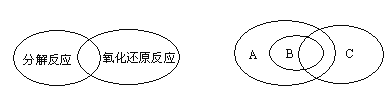
(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________。
(3)离子方程式是重要的化学用语,下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O=2NaOH+H2↑)。
错误观点 | 离子方程式 | |
① | 所有的离子方程式均可以表示一类反应 | _____ |
② | 所有酸碱中和反应均可表示为:H++OH-=H2O | _____ |
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
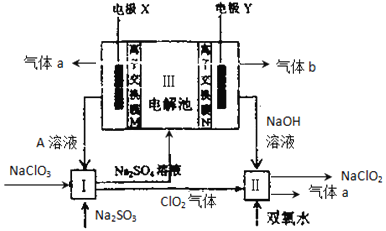
(1)Ⅰ中发生反应的还原剂是___________,气体a的名称是___________
(2)Ⅱ中反应的离子方程式是___________
(3)A的化学式是___________
(4)Ⅲ中电极X是___________,(填“阴极”“阳极”),其上发生 的电极反应为 _______________________。离子交换膜N是 ____(填“阴”“阳”)离子交换膜。
(5)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,该反应中氧化剂和还原剂的物质的量之比是 _______ 。
(6)NaClO2变质可转化为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_____(填“相同”“不相同”“无法判断”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是____________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组在习题解析中看到:“SO2通入Ba(NO3)2溶液出现白色沉淀,是因为在酸性环境中,NO3-将SO32-氧化成SO42-而产生沉淀”。有同学对这个解析提出了质疑,“因没有隔绝空气,也许只是![]() 氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:
氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:

(1)仪器a的名称为__。
(2)实验小组发现装置C存在不足,不足之处是__。
(3)用0.1mol/LBaCl2溶液、0.1mol/LBa(NO3)2溶液、食用油,配制4种溶液(见下表)分别在装置C中进行探究实验。
编号 | ① | ② | ③ | ④ |
试剂 | 煮沸过的BaCl2溶液25mL,再加入食用油25mL | 未煮沸过的BaCl2溶液25mL | 煮沸过的Ba(NO3)2溶液25mL,再加入食用油25mL | 未煮沸过的Ba(NO3)2溶液25mL |
对比①、②号试剂,探究的目的是___。
(4)进行①号、③号实验前通氮气的目的是__。
(5)实验现象:①号依然澄清,②、③、④号均出现浑浊。第②号实验时C中反应的离子方程式为__。
(6)图1-4分别为①,②,③,④号实验所测pH随时间的变化曲线。
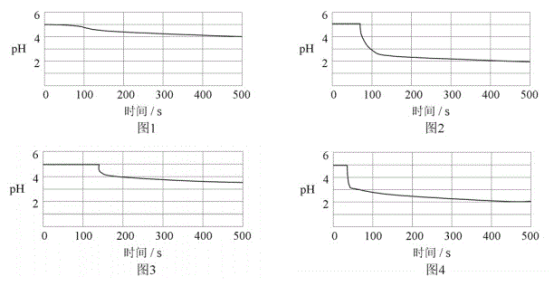
根据以上数据,可得到的结论是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】富镍三元层状氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)作为下一代锂离子电池的正极材被广泛关注和深入研究,纳米级TiO2形成的表面包覆对提高该材料的性能效果明显。回答下列问题:
(1)Li在元素周期表中的位置为___;基态Ni的电子排布式为___,基态Co3+有__个未成对电子。
(2)制备NCM811的过程中,残余的Li2CO3会破坏材料的界面,CO32-的空间构型是___,其中C原子的杂化方式为___。
(3)该电池初始充电过程中,会有C2H4等气体产生。C2H4分子中。![]() 键和
键和![]() 键数目之比为__。
键数目之比为__。
(4)TiO2的晶胞(![]() =
=![]() =
=![]() =90o)如图所示:
=90o)如图所示:
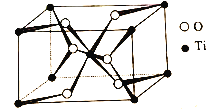
TiO2晶体中O原子的配位数是__,其晶胞参数为:a=b=459pm,c=295pm,该晶体的密度为__g/cm3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是某种低毒利尿药的主要成分,其合成路线如下(部分条件已省略):
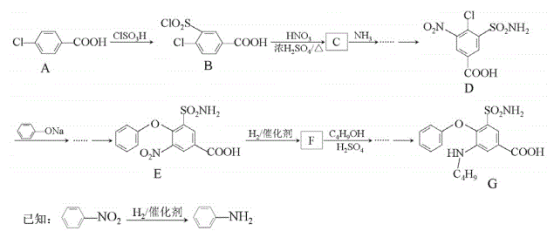
回答下列问题:
(1)A的化学名称为___。
(2)A→B的反应类型为___。
(3)F的结构简式为___。
(4)B→C的化学反应方程式为___。
(5)若G发生自身缩聚反应,其缩聚产物的链节结构为___(写一种)。
(6)C4H9OH的同分异构体中属于醇的有___种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为___。
(7)上述转化中使用的C4H9OH一般为正丁醇。以乙烯(其它无机试剂任选)为原料合成正丁醇的合成路线为___。
已知:
R1CHO+R2CH2CHO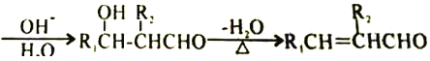
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(__________)两种物质都不是电解质
(__________)两种物质都是钠的化合物
(__________)两种物质都是氧化物
(__________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1 mol/L的如图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为______________。
②证明有红褐色胶体生成的实验原理是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)![]() B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
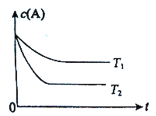
(1)上述反应是______________(填”吸热反应”或”放热反应”),温度T1_____T2,(填“大于”、“小于”或“等于”,下同)平衡常数K(T1)_______K(T2)。
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为___________。
②反应在0~5min区间的平均反应速率v(A)=____________。
(3)在温度T1时,若增大体系压强,A的转化率_________(填“增大”、“减小”或“不变”,下同),平衡常数________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com