
科目: 来源: 题型:
【题目】在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
(1)生成SO3 ____________ mol;
(2)O2的转化率为____________;
(3)平衡时体系中SO2的百分含量(体积分数)为____________;
(4)降低温度,O2的转化率____________;v正____________;(填“增大”、“减小”或“不变”)
(5)保持容器体积不变,加入He,则SO2的物质的量____________。(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应是氧化还原反应的是( )
A.AgNO3 + HCl ==AgCl↓+ HNO3
B.NH4HCO3 ![]() NH3↑+ CO2↑+ H2O
NH3↑+ CO2↑+ H2O
C.2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
D.CaO+H2O ==Ca(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
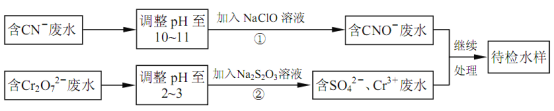
完成下列填空:
(1)HCN有剧毒,电子式是___,其分子属于___(填“极性”、“非极性”)分子。
(2)选用最详尽描述核外电子运动状态的方式,来表示氮原子的最外层电子:___,氮原子核外有___种能量不同的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是___。
a.相同条件下水溶液的酸性:HClO3>H2SO3
b.稳定性:HCl>H2S
c.相同条件下水溶液的pH:Na2S>NaCl
d.还原性:S2->Cl-
(4)写出流程②的离子方程式:___。
(5)反应②中,每消耗1.5mol Cr2O72-转移电子的数目为___个。
(6)取少量待检水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,用平衡移动原理解释产生该现象的原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某氧化铝样品中含有氧化铁和二氧化硅(一种酸性氧化物)杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。回答下列问题:
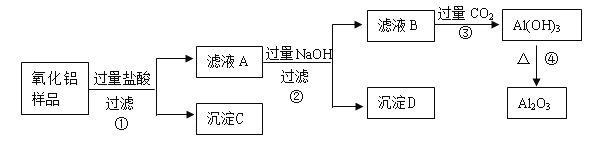
(1)在操作①中要用到的玻璃仪器有_____________________________________________;
(2)沉淀C的化学式是_____________。滤液B中含有的溶质有__________(写化学式);
(3)步骤③的离子方程式为_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
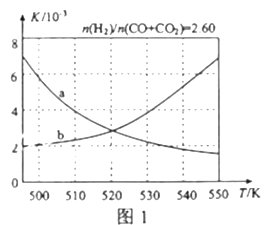 .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲中含有的化学键类型是___;常温下丁溶液显___性(填“酸”或“碱”或“中”),原因是____(用离子方程式表示);
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1∶2(M均显+1价),原子序数B大于A。回答下列问题:
①写出加热条件下上述生成丙的化学方程式____;
②已知常温下弱电解质的电离平衡常数如下:一水合氨![]() ,戊:
,戊:![]() ,
,![]() 。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为
。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为![]() 的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中
的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____
____![]() (同上)。
(同上)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
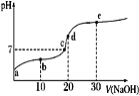
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1![]() 的KI溶液于试管,滴加0.1
的KI溶液于试管,滴加0.1![]() 的FeCl3溶液5~6滴,振荡;
的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:_________________
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1![]() 的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与![]() 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
实验操作 | 预期现象 | 结论 |
实验1:在试管A加入少量乙醚,充分振荡,静置 | _________________ | ________________ |
实验2:__________________________ __________________________________ | 若产生蓝色沉淀 | 则“猜想二”成立 |
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。某学习小组进行了以下探究活动:
(探究一)
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是___________________。
(2)另取该铁钉样品放入一定体积的浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。取336 mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为__________________,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为___________。
(探究二)
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
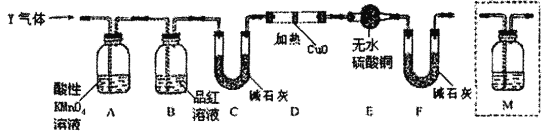
(3)装置B的作用是___________________。
(4)认为气体Y中还含有Q的理由是________________________________(用化学方程式表示)。
(5)为确认Q的存在,则M中盛放的试剂为___________,需将装置M添加于________(填序号)。
a.A之前 b.A—B间 c.B—C间 d.C—D间
(6)如果气体Y中含有H2,预计实验现象应是_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=![]()
③将0.1mol·L-1的NaHS和0.1mol·L-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A.①④B.②③C.③④D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com