
科目: 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。

请回答下列问题:
(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。

请回答:
(1)工业上制C用A不用H的原因 。
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)写出E物质的电子式 。
(5)J与H反应的离子方程式为 。
(6)写出G与熟石灰反应制取漂白粉的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是中学化学中常见的物质,已知C 为红棕色气体,它们之间的相互转化关系如下(部分反应条件及产物已略去)。

(1)若A为单质,则A的化学式为_________,试写出C→D反应的化学方程式:_________。
(2)A亦可为NH3,它与O2 在高温、催化剂的作用下反应生成B,此化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
Ⅰ.工业生产纯碱的工艺流程示意图如图:
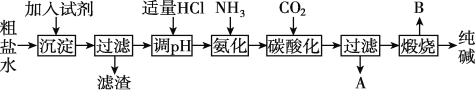
(1)为除去粗盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入试剂顺序合理的是____。
A.碳酸钠、氢氧化钠、氯化钡
B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡
D.氯化钡、氢氧化钠、碳酸钠
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是____;碳酸化时没有析出碳酸钠晶体,其原因是____。
(3)碳酸化后过滤,滤液A最主要的成分是____(填写化学式),检验这一成分的阴离子的具体方法是____。
(4)煅烧制取Na2CO3在____(填字母序号)中进行。
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.氧化铝坩埚
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________。
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(![]() )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率![]() =________%。
=________%。
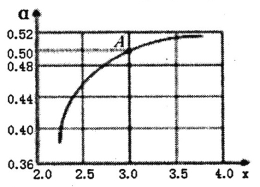
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______(kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
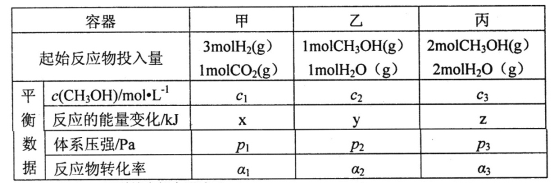
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________。
②下列说法正确的是________(填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
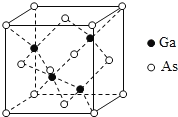
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法正确的是

A. Kb2的数量级为10-5
B. X(OH)NO3水溶液显酸性
C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]
D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)=c(X2+)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
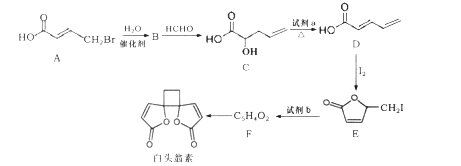
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
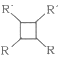
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成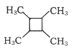 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答下列问题:
(1)硫元素是一种常见的非金属元素,硫原子的原子结构示意图为_______,自然界中存在的某种单质以八个原子结合,其分子式为_______,在我国古代,硫单质常被用于制作黑火药,爆炸时往往会产生一种刺激性气味的气体,这种气体产生的原因是(化学方程式)_______________________。硫单质还能够与金属元素反应,试写出硫单质与金属铜的反应方程式为______________________,产物中阴离子的电子式为_________。
(2)浓硫酸是一种重要的化工原料,具有____性、_____性、____性,请写出铜与浓硫酸反应的方程式_________________,此外浓硫酸也能够与某些非金属元素单质反应,试写出焦炭与浓硫酸反应的化学方程式__________________。
(3)氮元素是大气中含量最高的元素,其单质的电子式___________。由于该单质比较稳定,只能与部分活泼金属反应,比如在点燃条件下,可与金属镁反应,试写出该反应方程式___________________________。工业固氮的化学方程式为:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常用调味剂花椒油是一种从花椒籽中提取的水蒸气挥发性香精油,溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。

实验步骤:
(一)在A装置中的圆底烧瓶中装入![]() 容积的水,加1~2粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加1~2粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
(二)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏。
(三)向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体倾倒入蒸馏烧瓶中,蒸馏得花椒油。
(1)装置A中玻璃管的作用是_______。装置B中圆底烧瓶倾斜的目的是 ________。
(2)步骤(二)中,当观察到_______现象时,可停止蒸馏。蒸馏结束时,下列操作的顺序为_______(填标号)。
①停止加热②打开弹簧夹③关闭冷凝水
(3)在馏出液中加入食盐的作用是__ ;加入无水Na2SO4的作用是_______。
(4)实验结束后,用稀NaOH溶液清洗冷凝管,反应的化学方程式为_________。(残留物以![]() 表示)
表示)
(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加80.00mL0.5mol/LNaOH的乙醇溶液,搅拌,充分反应,加水配成200mL溶液。取25.00mL加入酚酞,用0.1moI/L盐酸进行滴定,滴定终点消耗盐酸20.00mL。则该花椒油中含有油脂_______ g/L。
(以 计,式量:884)。
计,式量:884)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com