
科目: 来源: 题型:
【题目】在不同温度下,水溶液中![]() 与
与![]() 有如图所示关系。下列说法正确的是
有如图所示关系。下列说法正确的是![]()
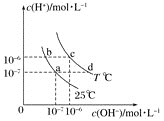
A.b点溶液中不可能存在![]()
B.b、c两点pH相同,但溶液的酸碱性不同
C.通过降温的方法,可使溶液的状态从d点变为a点
D.a点溶液中可能大量共存的离子:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积可变的密闭容器中发生可逆反应:2NO2(g)![]() 2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
A.单位时间内生成n mol O2的同时生成n mol NO2
B.NO2、NO、O2三者的物质的量浓度之比为2:2:1
C.混合气体的密度不再改变
D.容器中气体压强不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类不同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置。在实验开始时温度计水银球的位置应在___________,目的是_____________________________;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在___________________。

(3)烧杯B内盛装的液体可以是____________(写出一种即可)。
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是____________。(填字母)
a.pH试纸 b.碳酸氢钠粉末
c.红色石蕊试纸 d.银氨溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】化学已渗入我们的“衣、食、住、行、医”中。
(1)衣:区分羊毛线和棉纱线的方法是灼烧,羊毛线燃烧食能闻到__________气味。
(2)食:维生素C能增强人体对疾病的抵抗能力,中学生每天要补充60mg的维C。下列物质富含维生素C的是 ________![]() 填字母
填字母![]() 。
。
A.橙子 ![]() 猪肉
猪肉 ![]() 面粉
面粉
(3)住:下列属于直接利用太阳能辐射能加热物体而获得热能的是 ________![]() 填字母
填字母![]() 。
。
A.石蜡燃烧 ![]() 太阳能热水器
太阳能热水器 ![]() 燃料电池
燃料电池
(4)行:城市交通中大力推广新能源汽车对于改善空气质量的好处是 _______________
A.增加新型污染 ![]() 浪费电能
浪费电能 ![]() 减少空气污染
减少空气污染
(5)医:出现低血糖症状时需要尽快补充葡萄糖,葡萄糖的化学式是________。
(6)淀粉和纤维素是两种重要的多糖,这两种物质________![]() 填“能”或“不能”
填“能”或“不能”![]() 互称为同分异构体,淀粉遇到______显蓝色。
互称为同分异构体,淀粉遇到______显蓝色。
(7)发育出现障碍,患营养缺乏症,这主要是由摄入蛋白质不足引起的,蛋白质在人体内水解的最终产物是________;向蛋白质溶液中加入![]() 溶液会出现白色沉淀,该变化叫作________。
溶液会出现白色沉淀,该变化叫作________。
查看答案和解析>>
科目: 来源: 题型:
【题目】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应![]() 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
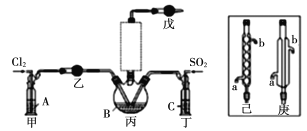
资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的化学方程式是:____________。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________(填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______(填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有________________。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是___________。
(5)通过佛尔哈德法可测定经过提纯后的产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00 mL(Ag++C1- AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000 mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN- AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00 mL。
①达到滴定终点的现象是____________。
②POCl3的质量分数为___________。
③已知:KSP(AgC1)=3
查看答案和解析>>
科目: 来源: 题型:
【题目】食品安全关系国计民生,影响食品安全的因素很多.
(1)聚偏二氯乙烯![]()

![]() 具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________
具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________![]() 写结构简式
写结构简式![]() 发生加聚反应生成的,该物质的分子构型是__________________________。
发生加聚反应生成的,该物质的分子构型是__________________________。
(2)劣质植物油中的亚油酸![]() 含量很低,下列关于亚油酸的说法中,正确的是_________。
含量很低,下列关于亚油酸的说法中,正确的是_________。
A.分子式为![]()
B.一定条件下能与甘油![]() 丙三醇
丙三醇![]() 发生酯化反应
发生酯化反应
C.能和NaOH溶液反应
![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
(3)假酒中甲醇![]() 含量超标,请写出Na和甲醇反应的化学方程式:________。
含量超标,请写出Na和甲醇反应的化学方程式:________。
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是________。
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有五种有机物,请回答下列问题:
A. | B. | C. |
D.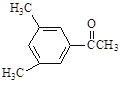 E.
E.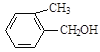 F.
F.![]()
(1)A物质中含有的官能团名称为_____________、______________。
(2)B的分子式为_________________。
(3)D的一氯代物最多有________________种。
(4)上述化合物中互为同分异构体的是_____;互为同系物的是____。(填字母)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
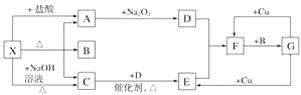
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com