
科目: 来源: 题型:
【题目】研究表明不含结晶水的X(由4种短周期元素组成),可作为氧化剂和漂白剂,被广泛应用于蓄电池工业等。为探究X的组成和性质,设计并完成了下列实验:
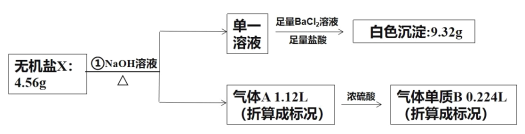
已知:气体单质B可使带火星的木条复燃。
(1)X中含有的元素为:____;图中被浓硫酸吸收的气体的电子式为:_____。
(2)请写出①的化学方程式:_____。
(3)已知X常用于检验Mn2+,它可将Mn2+氧化成MnO4-。请写出X溶液和少量MnCl2溶液反应的离子方程式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体混合物可能由Fe2O3、Fe、Na2SO3、NaBr、AgNO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如图所示:
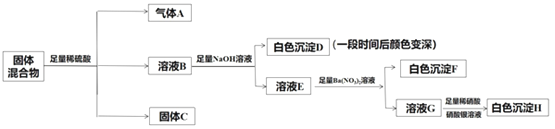
下列说法正确的是
A.气体A至少含有SO2、H2中的一种
B.固体C可能含有BaSO4或者Ag2SO4
C.该固体混合物中Fe2O3和Fe至少有其中一种
D.该固体混合物一定含有BaCl2,其余物质都不确定
查看答案和解析>>
科目: 来源: 题型:
【题目】把2mol/L CuCl2溶液和2mol/L盐酸等体积混合(假设混合后溶液体积等于混合前两种溶液的体积之和)。请计算:
(1)混合液中CuCl2和盐酸的物质的量浓度;_______________
(2)混合液中H+、Cu2+、Cl-的物质的量浓度;______________
(3)向溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时溶液中FeCl2的物质的量浓度。____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】胆矾CuSO4·5H2O可写为[Cu(H2O)4]SO4·H2O,其结构示意图如下:
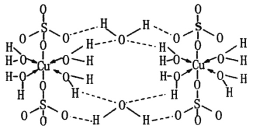
下列有关胆矾的说法正确的是
A.Cu2+的价电子排布式为3d84s1
B.所有氧原子都采取sp3杂化
C.胆矾中含有的粒子间作用力有离子键、极性键、配位键和氢键
D.胆矾所含元素中,H、O、S的半径及电负性依次增大
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按以下装置图进行实验,按要求填空。

(1)A中反应的化学方程式为________。
(2)B中浓硫酸的作用是____。
(3)C中发生反应的化学方程式为____,每反应1molNa2O2转移______mol电子。
(4)D中现象是_____,反应的离子方程式是_____________________。
(5)E中收集的气体主要是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)镁原子由1s22s22p63s2→1s22s22p63p2时原子释放能量,由基态转化成激发态____。
(2)价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素______。
(3)凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键______。
(4)24Cr原子的电子排布式是1s22s22p63s23p63d44s2______。
(5) 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构______。
(6)氯化钠晶体中,每个Na+周围距离相等的Na+共有12个______。
(7)金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子______。
(8) 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同______。
(9)干冰晶体中,每个CO2分子周围紧邻12个CO2分子______。
(10) 模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
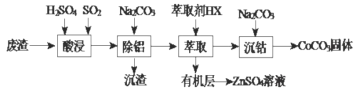
下列说法不正确的是( )
A.“酸溶”时发生氧化还原反应的离子方程式Co2O3+SO2+2H+=2Co2++H2O+SO42-
B.“除铝”过程中需要调节溶液 pH 的范围为5.0~5.4
C.在实验室里,“萃取”过程用到的玻璃仪器主要有分液漏斗、烧杯
D.在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为CoO
查看答案和解析>>
科目: 来源: 题型:
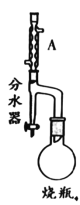
【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
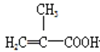 +CH3OH
+CH3OH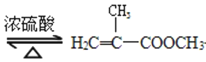 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl22H2O制备CuCl,并进行相关探 究。下列说法不正确的是( )
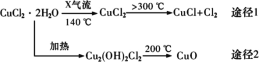
A.途径1中产生的Cl2可以回收循环利用
B.途径2中200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X气体是HCl,目的是抑制CuCl22H2O加热过程可能的水解
D.CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu+SO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知钼(Mo)的晶胞如图所示,钼原子半径为apm,相对原子质量为M,以NA表示阿伏加德罗常数的值。
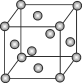
(1)钼晶体的堆积方式为__。
(2)钼原子的配位数为__。
(3)构成钼晶体的粒子是__。
(4)金属钼的密度为__g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com