
科目: 来源: 题型:
【题目】100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。下列叙述中不正确的是
A.此时水的离子积Kw=1×10-14B.水电离出的c(H+)=1×10-10molL-1
C.水的电离程度随温度升高而增大D.c(Na+)=c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数都是1,Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍,且X与Z同主族。由此可知:
(1)写出元素符号:W为_________,Z为_________
(2)W2X是由_________键组成的分子,其电子式为_________
(3)写出Y的最高价氧化物对应水化物与Z的最高价氧化物对应水化物反应的离子方程式_________
查看答案和解析>>
科目: 来源: 题型:
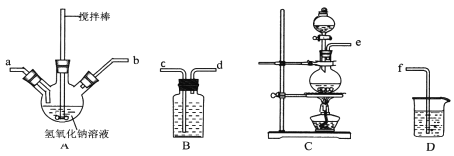
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。
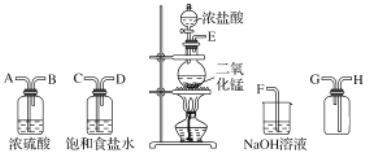
(1)连接上述仪器的正确顺序(填各接口处的字母):____ 接____;____接____;____接_____;____接____。
(2)装置中,饱和食盐水的作用是________;NaOH溶液的作用是_______。
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到_____,反应的化学方程式为________。
(4)写出下列反应的离子方程式:
①气体发生装置中进行的反应:____。
②NaOH溶液中发生的反应:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在两个固定体积均为1 L密闭容器中以不同的氢碳比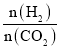 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法正确的是 ( )
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法正确的是 ( )
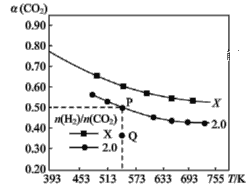
A.该反应在常温下不可能自发进行
B.氢碳比,X<2.0
C.若起始时CO2、H2浓度分别为0.5 mol·L-1、1.0 mol·L-1,则可得P点对应温度的平衡常数的值为512
D.向P点状态的容器中,按2∶4∶1∶4的比例再充入CO2、H2、C2H4、H2O,再次平衡后α(CO2)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,已知①有机物A的相对分子质量是28,它的产量是衡量一个国家石油化工水平的标志;②2CH3CHO+O2![]() CH3COOH;③B和D都是日常生活食品中常见的有机物;④E是具有浓郁香味、不易溶于水的油状液体;⑤F是一种高聚物,生活中用于制造食物保鲜膜。
CH3COOH;③B和D都是日常生活食品中常见的有机物;④E是具有浓郁香味、不易溶于水的油状液体;⑤F是一种高聚物,生活中用于制造食物保鲜膜。
回答下列问题:
(1)写出A的结构简式_________,D的结构简式_________
(2)写出下列反应的反应类型:②_________,④_________
(3)写出反应④的化学方程式:_________
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在周期表中的位置关系如右图所示,X原子最外层有5个电子。下列说法正确的是
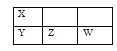
A.离子半径:W< Z2B.还原性:Z2<W
C.酸性:H3YO4 >HXO3D.氢化物的稳定性:YH3> H2Z
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Fe3++Cu=Fe2++Cu2+
B.AgNO3溶液与NaCl溶液的反应:Ag++Cl-=AgCl↓
C.Cu(OH)2与CH3COOH溶液的反应:OH-+H+=H2O
D.CaCO3与HNO3溶液的反应:![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R、Q是原子序数依次增大的前20号元素。X2是通常状况下密度最小的气体;Z与R同主族,R的一种固体单质在空气中易自燃;Y、W最外层电子数之和是Z的2倍,W有W2、W3两种常见单质;含Q的化合物焰色反应呈紫色。请回答下列问题:
(1)X、W、R、Q原子半径由大到小的顺序是(写元素符号)__________;请写出Z在周期表中的位置____________________。
(2)由上述元素组成的物质YW(ZX2)2是一种中性肥料,请写出它的电子式______________。
(3)请设计实验比较Z与R元素的非金属性强弱____________________。
(4)X、Y形成的化合物中含有非极性键且相对分子质量最小的物质是________。(写化学式)
(5)R的简单氢化物具有强还原性,将其通入硫酸铜溶液能生成两种最高价含氧酸和一种单质,请写出该反应的化学方程式__________________________________________________。
(6)Y的最高价氧化物与Q的最高价氧化物的水化物按物质的量之比1:2反应,所得溶液中离子浓度由大到小的顺序____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
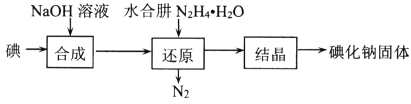
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )
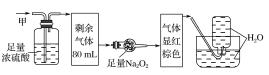
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【答案】B
【解析】
该气体无色,说明其中不含NO2;气体通过浓硫酸体积减小,说明其中有NH3;气体通过足量Na2O2后显红棕色,说明其中含有CO2和NO,故不含O2;最后通入水中无气体剩余,说明其中不存在N2,选项B正确,故答案为B。
【题型】单选题
【结束】
19
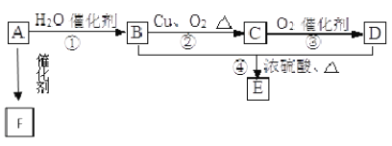
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
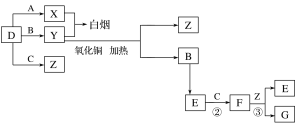
请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
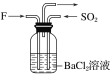
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com