
科目: 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
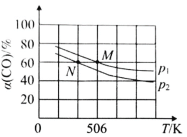
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验。
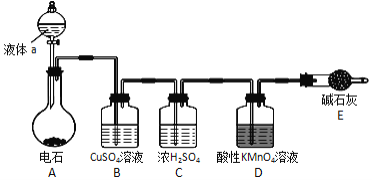
(1)写出实验室制取乙炔的化学方程式:____;
(2)实验室制取乙炔时,分液漏斗中的液体a通常是____;
(3)装置D中的现象是:___;
(4)若D装置中药品为溴水,其生成四溴代物的反应方程式为:____;
(5)工业上常用乙炔、饱和食盐水等物质作原料来合成聚氯乙烯,请写出相关方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH
请回答:
(1)写出⑤的官能团的名称______。
(2)与①互为同系物的是______(填序号)。
(3)写出④ 的同分异构体的结构简式________________。
(4)写出与②发生加成反应生成乙烷的化学方程式_________________________。
(5)③与⑤发生反应的化学方程式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,关于氢氧化钠和氨水两种溶液的比较,下列说法正确的是( )
A.pH 相等的两溶液中:c(Na+)=c(NH4+)
B.分别中和 pH 相等、体积相等的两溶液,所需HNO3的物质的量相同
C.相同浓度的两溶液,其导电能力相同
D.相同浓度的两溶液,分别通入 HCl 气体反应后呈中性的溶液中(忽略溶液体积变化):c(NH4+)=c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,属于加成反应的是
A.CH4+2O2![]() CO2+2H2O
CO2+2H2O
B.CH2=CH2+H-OH![]() CH3-CH2OH
CH3-CH2OH
C.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D.HCl+AgNO3=AgCl![]() +HNO3
+HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】将相同的锌片和铜片按图示方式插入同浓度的稀硫酸中,以下叙述正确的是

A. 两烧杯中铜片表面均无气泡产生 B. 两烧杯中溶液的H+浓度都减小
C. 产生气泡的速率甲比乙慢 D. 甲中铜片是正极,乙中铜片是负极
查看答案和解析>>
科目: 来源: 题型:
【题目】请写出电子式
(1)原子的电子式
H____ 、Ca ____、N____、 O____、 Cl____ 、C____ 、 Al____
(2)离子的电子式
①简单阳离子:氢离子____ 钾离子____ 钙离子____
②简单阴离子:氯离子____ 氧离子____
③复杂阴、阳离子:铵根离子____ 氢氧根离子____ 过氧根离子(![]() )____
)____
(3)离子化合物的电子式
NaCl____ CaO____ CaCl2_____ CaF2 ____ Na2O ____ Na2O2____
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S废气资源化的原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1,如图为H2S燃料电池示意图。下列说法正确的是( )
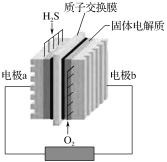
A.电极a为电池的正极
B.电极b上发生的电极反应为:O2+4H++4e-=2H2O
C.电路中每流过4 mol电子,电池会产生632 kJ热能
D.22.4 L H2S参与反应时,2 mol H+经质子交换膜进入正极区
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
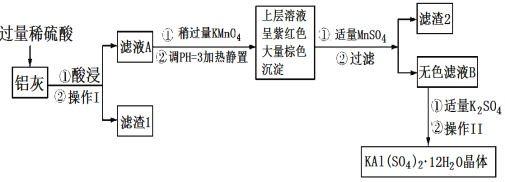
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应能通过原电池的形式来实现的是
A.Cu+2Ag+=2Ag+Cu2+B.Cu+2H+=H2↑+Cu2+
C.CaCO3+2HCl=CaCl2+CO2↑十H2OD.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com