
【题目】相同温度下,关于氢氧化钠和氨水两种溶液的比较,下列说法正确的是( )
A.pH 相等的两溶液中:c(Na+)=c(NH4+)
B.分别中和 pH 相等、体积相等的两溶液,所需HNO3的物质的量相同
C.相同浓度的两溶液,其导电能力相同
D.相同浓度的两溶液,分别通入 HCl 气体反应后呈中性的溶液中(忽略溶液体积变化):c(NH4+)=c(Na+)
【答案】A
【解析】
A项、根据电荷守恒可知,pH相等的两溶液中c(Na+)=c(NH![]() )=c(OH-)-c(H+),故A正确;
)=c(OH-)-c(H+),故A正确;
B项、pH相等、体积相等的两溶液含有的NaOH的物质的量比NH3·H2O少,则分别中和所需HNO3的物质的量前者少的多,故B错误;
C项、氢氧化钠是强电解质,一水合氨是弱电解质,相同浓度的氢氧化钠和氨水溶液中,溶液中离子浓度前者比后者大,导电能力不同,故C错误;
D项、氢氧化钠是强电解质,一水合氨是弱电解质,相同浓度的氢氧化钠和氨水溶液,分别通入HCl气体反应后呈中性时,氢氧化钠得到的是氯化钠溶液,氨水得到的是一水合氨和氯化铵的混合溶液,前者通入的氯化氢的物质的量大,则溶液中c(Na+)>c(NH![]() ),故D错误;
),故D错误;
故选A。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且书写正确的是
A. 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O==Ni(OH)2+OH-
C. AgOH沉淀溶于氨水:AgOH+2NH3·H2O==[Ag(NH3)2]++OH-+2H2O
D. 已知苯甲酸的酸性比碳酸强,向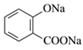 溶液中通入过量CO2:
溶液中通入过量CO2: +2CO2+2H2O—→
+2CO2+2H2O—→![]() +2HCO
+2HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值用 NA 表示。下列说法中正确的是( )
A.33.6L 丙烯(标准状况)与足量 HCl 发生加成反应,生成 1-氯丙烷个数为1.5NA
B.14g 分子式为CnH2n 的链烃中含有的C—H 键的数目为 NA
C.2mol 冰醋酸与 4mol 乙醇一定条件下充分反应,生成乙酸乙酯个数为 2NA
D.1L lmol/L 的葡萄糖溶液中,溶质所含羟基的个数为 5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是1:1:6,则该化合物的结构简式为
A.CH3-O-CH2-CH3B.![]()
C.CH3CH2CH2OHD.C3H7OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
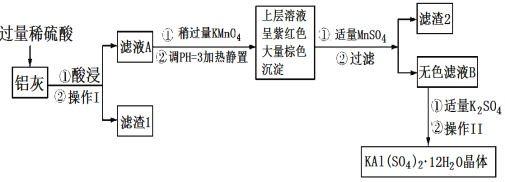
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)①-中,属于长周期的元素是______![]() 填序号
填序号![]() 。
。
(2)①-![]() 填元素符号
填元素符号![]() ,在空气中燃烧的产物是______
,在空气中燃烧的产物是______![]() 写出电子式
写出电子式![]() 。
。
(3)①-中中,最不活泼的元素其原子结构示意图为______。
(4)③④⑤三种元素对应的简单阳离子中,半径最大的离子结构示意图为______。
(5)在这些元素的最高价氧化物对应水化物中,呈两性的氢氧化物是______![]() 写化学式
写化学式![]() 。
。
(6)若将④⑤的单质用导线相连插入稀硫酸溶液中形成原电池,则该原电池的负极反应式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E原子序数依次增大;A与B可形成4核10电子的分子;C、E同主族,D、E同周期;C和D可形成离子化合物D2C,D2C中阴阳离子的电子层结构相同,且电子总数为30。
请回答下列问题![]() 用元素符号表示
用元素符号表示![]() :
:
(1)元素A的一种同位素质子数与中子数相等,这种同位素的符号是______。
(2)元素B在周期表中的位置是______。
(3)元素A与B形成10电子的分子,其水溶液呈碱性,用电离方程式表示______。
(4)元素A、B、C形成的原子个数比为4:2:3的盐,属于______![]() 填“离子“或“共价“
填“离子“或“共价“![]() 化合物,含有的化学键类型为______。
化合物,含有的化学键类型为______。
(5)元素C、D形成化合物D2C2的电子式为______,其与水反应的离子方程式为______。
(6)元素C、D、E、F形成简单离子的半径由小到大的顺序为______。
(7)元素E与F相比,元素原子得电子能力较强的是______,用离子方程式证明______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验方法正确的是( )
A.加入稀盐酸,产生无色无味的气体,则溶液中一定含有![]()
B.先加氯水,再加![]() 溶液,溶液变为血红色,则溶液中一定含有
溶液,溶液变为血红色,则溶液中一定含有![]()
C.用洁净的玻璃棒蘸取溶液在酒精灯上灼烧,火焰呈黄色,则溶液中一定含有![]()
D.向溶液中加入稀盐酸至酸性,无明显现象,再加入![]() 溶液产生白色沉淀,则溶液中定含有
溶液产生白色沉淀,则溶液中定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、CO32-、SO42-、NO3-中的若干种离子,离子浓度均为0.1mol/L,某同学进行如下实验。下列说法正确的是

A. 无法确定沉淀C 的成分
B. 无法确定原试液中是否存在K+、Al3+、Cl-、
C. 试液中可能含有CO32-、K+、NH4+
D. 试液中一定存在的离子为NH4+、Fe2+、SO42-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com