
科目: 来源: 题型:
【题目】下列有关说法不正确的是( )
A.铅蓄电池放电时的负极和正极的质量均增加
B.CaCO3(s)=CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H>0
C.对于发应2H2O2![]() 2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
D.H2O与金属Na反应生成1molH2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】以海水为电解质的Mg-AgCl电池在军事上可用作电动鱼雷的电源,其电池反应离子方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。该电池工作时,下列说法正确的是( )

A.正、负极的质量均减少
B.电子由AgCl经外电路流向Mg
C.AgCl电极发生氧化反应
D.该装置实现了电能向化学能的转化
查看答案和解析>>
科目: 来源: 题型:
【题目】高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如图:
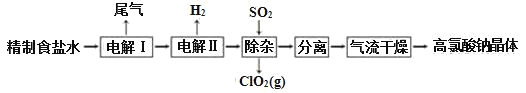
(1)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为______。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
除去盐水中的Br-可以节省电解过程中的电能,其原因是_____。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有_____(填化学式)。“电解Ⅱ”的化学方程式为____。
(3)“除杂”的目的是除去少量的未反应的NaClO3杂质,该反应的离子方程式为_____。“气流干燥”时,温度控制在80~100℃,温度不能过高的原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8,
四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8,![]() 元素原子的
元素原子的![]() 层电子数与
层电子数与![]() 、
、![]() 层电子数之和相等,
层电子数之和相等,![]() 元素原子的
元素原子的![]() 、
、![]() 层电子数之和等于电子总数的一半。试回答下列问题。
层电子数之和等于电子总数的一半。试回答下列问题。
(1)四种元素的符号依次是![]() ______,
______,![]() ______,
______,![]() ______,
______,![]() ______;它们的原子半径由大到小的顺序是______(用元素符号表示)。
______;它们的原子半径由大到小的顺序是______(用元素符号表示)。
(2)试写出四种元素的离子结构示意图:![]() ______,
______,![]() ______,
______,![]() ______,
______,![]() ______。它们的离子半径由大到小的顺序是______(用离子符号表示)。
______。它们的离子半径由大到小的顺序是______(用离子符号表示)。
(3)分别写出四种元素的最高价氧化物对应水化物的化学式:______。
(4)分别写出![]() 、
、![]() 两元素的气态氢化物的化学式:______。
两元素的气态氢化物的化学式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】向足量稀硫酸(不考虑反应过程中硫酸浓度的变化)中加入一定量的锌粒,同时不断向其中滴加硫酸铜溶液,观察到生成氢气的速率如图所示。下列有关说法错误的是( )
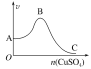
A.AB段速率的变化可能是因为溶液温度逐渐升高
B.AB段速率的变化可能是因为形成了铜锌原电池
C.BC段速率的变化可能是因为溶液温度逐渐降低
D.BC段速率变化的原因主要是置换出的铜太多,覆盖在锌粒表面,阻碍了反应的进行
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用蒸馏的方法可将叔丁醇从二者的混合物中分离出来
D. 两种醇发生消去反应后得到同一种烯烃
查看答案和解析>>
科目: 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 三种短周期元素,其原子半径的大小顺序为
三种短周期元素,其原子半径的大小顺序为![]() ,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中
,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中![]() 为
为![]() 、
、![]() 组成的双原子分子,
组成的双原子分子,![]() 和
和![]() 均为10电子分子。下列判断错误的是( )
均为10电子分子。下列判断错误的是( )
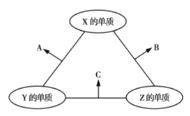
A.![]() 的最外层电子数为6
的最外层电子数为6
B.![]() 和
和![]() 之间不可能发生氧化还原反应
之间不可能发生氧化还原反应
C.![]() 的沸点高于
的沸点高于![]() 的沸点
的沸点
D.![]() 不能溶于
不能溶于![]() 中
中
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用环己醇制备环己酮,使用的氧化剂可以是次氯酸钠、重铬酸钾等。

已知:环己醇沸点:160.8℃,微溶于水;
环己酮沸点:155.6℃,微溶于水;
醋酸沸点117.9℃,和水以任意比例互溶。
下列装置分别是产品的合成装置和精制装置示意图:
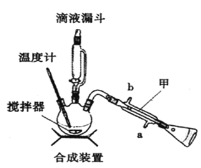
合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2mL环己醇和25mL冰醋酸。开动搅拌器,将40mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5min。然后,在室温下继续搅拌30min后,在合成装置中再加入30mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是_____________。
(2)三颈烧瓶的容量为_____________(填“50mL"、“100mL”或“250mL")。
(3)滴液漏斗具有特殊的结构,主要目的是_____________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_____________。然后加入精制食盐使之变成饱和溶液,将混合液倒入_____________中,分离得到有机层。
(5)用如图对粗产品进行精制,蒸馏收集_____________℃的馏分。
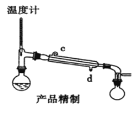
(6)检验环己酮是否纯净,可使用的试剂为_____________。
A.重铬酸钾溶液B.金属钠C.新制的氢氧化铜悬浊液D.醋酸溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
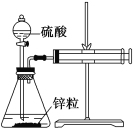
A. 用锌粒来表示10 s内该反应的速率为0.013 g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s)
D. 用H2来表示10 s内该反应的速率为0.000 2 mol/s
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是一种重要的化工原料,可用来合成高分子化合物PC塑料![]() ,其合成路线如下:
,其合成路线如下:
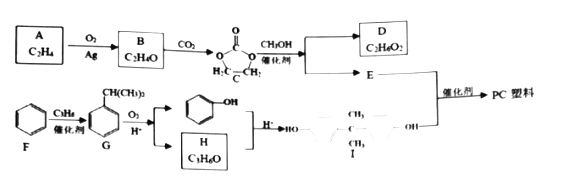
已知:![]()
回答下列问题:
(1)D的名称是_________,H的官能团名称是_________。
(2)由C到E、F到G的反应类型分别是_________、_________。
(3)B是一个三元环状有机物,其结构简式为_________。
(4)C生成D和E的化学方程式为_________。
(5)E和I生成PC塑料的化学方程式为_________。
(6)H和苯酚的反应还可能生成分子式为![]() 的产物M,则能满足以下条件的芳香化合物M的同分异构体有_________种;
的产物M,则能满足以下条件的芳香化合物M的同分异构体有_________种;
①![]() 该物质能消耗
该物质能消耗![]() ②苯环上有3个取代基
②苯环上有3个取代基
其中,核磁共振氢谱各组峰面积之比为1:2:2:1:6的M的结构简式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com