
科目: 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A.铜的电解精炼中,若阳极质量减少32g,则转移电子的电子数为6.02×1023
B.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol
D.已知稀溶液中:H+(aq)+OH-(aq)=H2O(l)ΔH=-53.7kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于53.7kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下的定容密闭容器中,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g), 下列哪种情况,能表明反应达到平衡状态
2SO3(g), 下列哪种情况,能表明反应达到平衡状态
A. SO3的体积百分含量保持不变
B. SO2速率是O2速率的2倍
C. SO3的浓度是O2浓度的2倍
D. 单位时间内SO2消耗的浓度等于SO3生成的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是 ( )
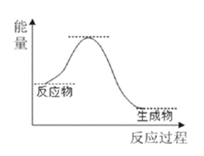

A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂非极性键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期表和元素周期律,下列叙述正确的是( )
A.在周期表金属与非金属分界处寻找用于研制新农药的元素
B.H2、D2、T2互为同位素
C.如图所示实验可证明元素的非金属性:Cl>C>Si
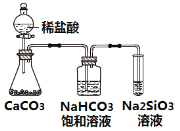
D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目: 来源: 题型:
【题目】某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是
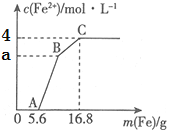
A. 原溶液的c(H+)=4mol·L—1
B. 若a=3,则原溶液中c(Cu2+)=1mol·L—1
C. 原溶液中的c(NO3-)=7mol·L-1
D. BC段发生反应的离子方程式为Cu2++Fe=Fe2++Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
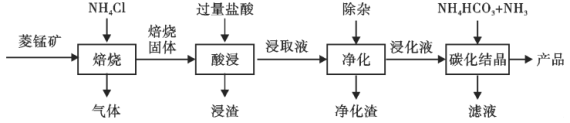
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
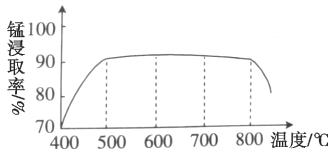
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
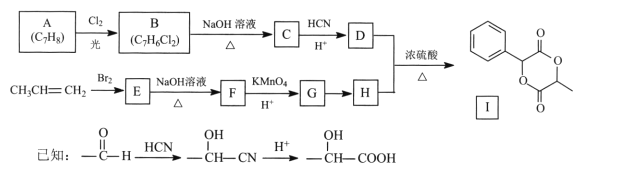
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com