
科目: 来源: 题型:
【题目】“电化学”与人类生产和生活密不可分。
(1)如图为相互串联的甲、乙两个电解池,试回答下列问题。
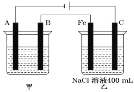
①乙池中若滴入少量酚酞,开始一段时间后,_____电极附近呈红色(填“铁”或“碳”)。
②甲池若为用电解原理精炼铜的装置,A极电极反应式为_____。
③甲池若为用电解原理精炼铜的装置,阴极增重12.8g时,则乙池阳极放出气体在标准状况下的体积为_____(不考虑气体溶解情况)。
(2)人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
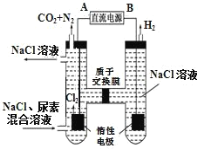
①阳极反应生成的氯气将尿素氧化而得以除去,试写出该反应的化学方程式_____。
②若两极共收集到气体13.44L(标况),则除去的尿素质量为_____ g(忽略气体的溶解)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列问题:
![]()
(1)A、B、C之间有如图的转化关系,若A为AlCl3,写出A和C反应的离子方程式:_______________;
(2)检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是_____________ 、_______________
(3)已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式____________________。
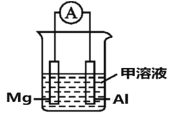
(4)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为__________。若电解液为氢氧化钠溶液,负极的电极反应为________________。
(5)写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:__________________。
(6)若铅蓄电池负极质量增加19.2g,则其正极质量增加____________ g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是 ( )
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. CaCO3的电离:CaCO3![]() Ca2++CO32-
Ca2++CO32-
C. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. Na2S溶液的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目: 来源: 题型:
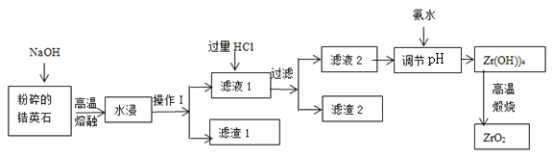
【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取乙酸乙酯的主要步骤如下:
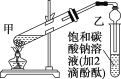
①在甲试管(如图)中加入3mL乙醇、2mL浓硫酸和2mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入碎瓷片,用小火均匀地加热3~5min。
③待试管乙中收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯、洗涤、干燥。
(1)配制该混合溶液的主要操作步骤为______;反应中浓硫酸的作用是_____。
(2)写出制取乙酸乙酯的化学方程式:_________。
(3)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(4)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应该从仪器的________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X:可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,转化关系如图所示。反应过程中有一种气体在空气中会变为红棕色。回答下列问题:
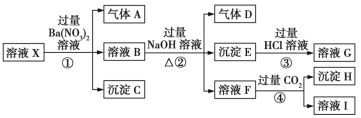
(1)沉淀C是___(填化学式),由此可确定溶液X中肯定不存在的阳离子有___。
(2)气体A是___(填化学式),产生气体A的离子方程式为___。
(3)步骤④中发生反应的离子方程式为___。
(4)根据题给信息和图中转化关系,可以确定溶液X中肯定存在的离子有___,可能存在的离子有___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
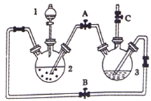
(1)稀硫酸应放在___(填写仪器名称)中。
(2)本实验通过关闭开关___、打开开关___,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___。
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为___。滴定终点的现象是___。
通过实验数据计算的该产品纯度为___(用字母a、b表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程中的能量变化如图所示。已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH1=-99 kJ/mol。请回答下列问题:
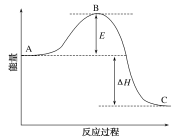
(1)图中A、C分别表示_____、____,E的大小对该反应的反应热有无影响?____(填“有”或“无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____,理由是_________。
(2)图中ΔH=____kJ/mol。
(3)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=____ mol·L-1·min-1,v(SO3)=___mol·L-1·min-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列十种物质:
①0.1mol/L硫酸、②小苏打、③纯碱、④二氧化碳、⑤葡萄糖、⑥0.1mol/LNaOH溶液、 ⑦氢氧化铁胶体、⑧氨水、⑨Al2O3、⑩硫酸铁溶液
(1)上述十种物质中,属于非电解质的有___(填序号)。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,这两种物质的序号是___(填序号)。
(3)既能跟盐酸反应又能跟NaOH溶液反应的是___(填序号)。
(4)现有100mL⑩溶液中含Fe3+5.6g,则溶液中c(SO42-)=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com