
科目: 来源: 题型:
【题目】铁的许多化合物在生产、生活中有着广泛的应用,如FeCl3是重要的金属蚀刻剂、水处理剂;影视作品拍摄中常用Fe(SCN)3溶液模拟血液;FeS可用于消除水中重金属污染等。
(1)已知:①3Cl2(g)+2Fe(s)=2FeCl3(s) ΔH1=akJ·mol-1
②2FeCl2(s)+Cl2(g)=2FeCl3(s) ΔH2=bkJ·mol-1
则2FeCl3(s)+Fe(s)=3FeCl2(s) ΔH3=____。
(2)将c(FeCl3)=0.2mol·L-1的溶液与c(KSCN)=0.5mol·L-1的溶液按等体积混合于某密闭容器发生反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
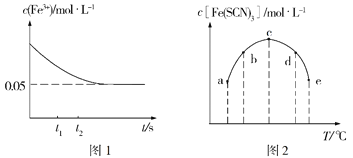
①研究表明,上述反应达到平衡后,向体系中加入适量KCl固体后,溶液颜色无变化,其原因是___,根据图1分析,在t1、t2时刻,生成Fe3+的速率较大的是____时刻。
②常温下Fe3++3SCN-![]() Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
③根据图2判断,该反应的ΔH___0(填“>”或“<”),图中五个点对应的状态中,一定处于非平衡态的是___(填对应字母)。
(3)利用FeS可除去废水中的重金属离子,如用FeS将Pb2+转化为PbS可消除Pb2+造成的污染,当转化达到平衡状态时,废水中c(Fe2+)=___c(Pb2+)[填具体数据,已知Ksp(PbS)=8×10-28,Ksp(FeS)=6×10-18]。
查看答案和解析>>
科目: 来源: 题型:
【题目】.高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO42-+8H+
B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH-
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O=2LiOH+H2↑。电池工作时,下列说法错误的是( )
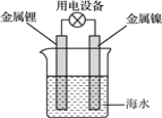
A.金属锂作负极
B.电子从锂电极经导线流向镍电极
C.海水作为电解质溶液
D.可将电能转化为化学能
查看答案和解析>>
科目: 来源: 题型:
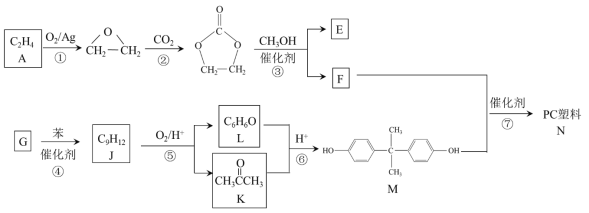
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:
已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】对于工业合成氨反应:N2+3H2![]() 2NH3,下列说法错误的是( )
2NH3,下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率B.升高温度可以增大反应速率
C.增大N2浓度可以使H2完全反应D.增大N2浓度可以增大反应速率
查看答案和解析>>
科目: 来源: 题型:
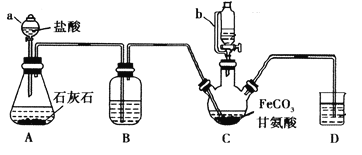
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目: 来源: 题型:
【题目】发酵法制酒精的过程可粗略表示如下:
①(C6H10O5)n+n H2O![]() n C6H12O6
n C6H12O6
② C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化学方程式中(C6H10O5)n可能表示___(填物质名称);
(2)C6H12O6名称是__,它的结构简式为___,常用____反应实验或它与氢氧化铜悬浊液的反应来检验其存在。
(3)为检验苹果成熟过程中发生了反应①,可在青苹果汁中滴加碘酒,溶液呈___色,向熟苹果汁中加入Cu(OH)2悬浊液,加热,反应生成___ (填实验现象)。
查看答案和解析>>
科目: 来源: 题型:
【题目】酸性或碱性溶液中铝均可与NO![]() 发生氧化还原反应,转化关系如图:
发生氧化还原反应,转化关系如图:
已知:气体D和A溶液反应生成白色沉淀,气体D和F反应可生成盐。
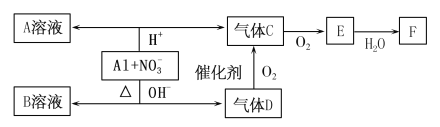
请回答下列问题:
(1)写出铝在碱性条件下与NO![]() 反应的离子方程式_________。
反应的离子方程式_________。
(2)在酸性条件下,被还原的NO![]() 与Al的物质的量之比是_______。
与Al的物质的量之比是_______。
(3)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C和E都转化为无毒的气态单质,请写出D和C反应的化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com