
科目: 来源: 题型:
【题目】如图所示,A、B、C、D、E、F、G均为有机物,它们之间有如下转化关系(部分产物和反应条件已略去)。已知B分子中含有苯环,其蒸气密度是同温同压下H2密度的59倍,1molB最多可以和4molH2发生加成反应,B的苯环上的一个氢原子被硝基取代所得的产物有三种。E和G都能够发生银镜反应。F分子中含有羟基和羧基,在一定条件下可以聚合生成高分子化合物。
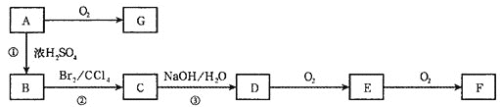
请回答下列问题:
(1)A的结构简式____________。
(2)反应①的反应类型是________。
(3)E与银氨溶液反应的化学方程式为_______。
(4)等物质的量的A与F发生酯化反应,所生成有机物的结构简式为________。
(5)A的一种同分异构体与浓H2SO4共热,也生成B和水,该同分异构体的结构简式为________。
(6)E有多种同分异构体,其中属于酯类且具有两个对位取代基的同分异构体共有_____种。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
起 始 量 | 温度T℃ 平衡常数K=64 恒容且V=1L | ||||
Fe2O3 | CO | Fe | CO2 | ||
甲 | 1 mol | 1 mol | 1 mol | 1 mol | |
乙 | 1 mol | 2 mol | 1 mol | 1mol | |
A.容器中混合气体的平均相对分子质量不变时反应达平衡
B.乙中CO2的体积分数为50%
C.甲中CO的转化率为60%
D.甲、乙两容器中 CO的体积分数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】苹果酸的结构简式为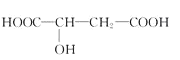 苹果酸可能发生的反应是( )
苹果酸可能发生的反应是( )
①与NaOH溶液反应;②与石蕊试液作用变红;③与金属钠反应放出气体;
④一定条件下与乙酸酯化;⑤一定条件下与乙醇酯化:
A.①②③B.①②③④C.①②③⑤D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂、媒染剂。实验室拟用废旧印刷电路板(含有Cu、Fe、Al、Zn)制备该晶体,具体流程如下:

已知:硫酸四氨合铜易溶于水,不溶于乙醇、四氯化碳等有机溶剂;常温下,硫酸四氨合铜在空气中易与水和二氧化碳反应,受热时易失氨。
(1)某科研小组选取一定量的稀硝酸和稀硫酸的混合酸溶解废旧印刷电路板时,得出温度与铜的浸出率关系如图所示。步骤①中采用合适的加热方式是___;温度越高,铜的浸出率反而下降,原因可能是___。
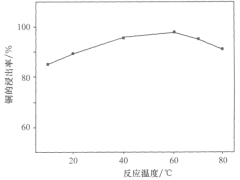
(2)步骤②、③需要的玻璃仪器有___;检验“水相Ⅱ”中是否含有Fe3+所需试剂为___。
(3)步骤④中氨水必须适当过量的原因是___。
(4)步骤⑥的具体操作为___。
(5)样品中NH3含量测定:实验装置如图所示,称取0.3400g样品放入圆底烧瓶中,加入80mL水溶解,再加入10%NaOH溶液10.00mL。在锥形瓶中,准确加入0.5000mol·L-lHC1标准溶液36.00mL,放入冰水浴中冷却。先大火后小火加热烧瓶,并保持微沸1h左右。取出插入HC1溶液中的导管,从冰水浴中取出锥形瓶,滴加2滴0.1%甲基红溶液,用0.5000mol·L-1NaOH标准溶液滴定剩余溶液,消耗NaOH标准溶液28.00mL。

样品中NH3的质量分数为___(保留两位有效数字),实验检测结果比理论值偏小的原因可能是___(写一种可能原因)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物M的球棍模型如图所示:
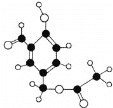
(1)请写出物质M的分子式_______含氧官能团名称_________
(2)M在一定条件下,可以发生水解反应,生成A、B两种物质(它们的相对分子质量关系A>B)。B可以用以下方法制得:X![]() Y
Y![]() Z
Z![]() W
W![]() B。其中W能发生银镜反应。则I属于________反应(填反应类型)
B。其中W能发生银镜反应。则I属于________反应(填反应类型)
(3)写出反应Ⅱ的化学方程式:_____。反应Ⅲ的化学方程式:________。
(4)1molA分别与Na、NaOH溶液反应,所用Na、NaOH物质的量的最大值之比是_______。
(5)A有多种同分异构体,符合下列三个件的同分异构体有_______种,其中分子结构中只有六种氢原子的结构简式为__________
a.环上只有两个取代基
b.与FeCl3溶液显紫色;
c.能发生银镜反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)是制备医药、炸药的一种重要原料,采用“亚硝酸甲酯——水合肼法”制备叠氮化钠的生产流程如下:
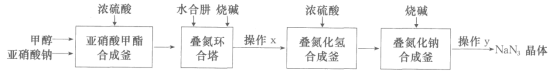
回答下列问题:
(1)亚硝酸甲酯合成釜中生成的亚硝酸甲酯(CH3ONO)易转化为气态进入叠氮环合塔,写出生成CH3ONO的化学反应方程式:___。
(2)叠氮环合塔中生成叠氮化钠的反应方程式为___。
(3)水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为___;叠氮环合塔中滴加的烧碱溶液要适当过量,目的是__ ;生产流程中操作x为加热、浓缩,此时所得浓缩液的溶质中含钠的化合物有Na2SO4和___。
(4)该生产过程中可循环使用的物质是___。
(5)生产中有HN3生成,请设计实验证明HN3为弱酸:___。
(6)化工生产中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol·L-1的NaClO溶液___mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12:3:8。液态烃B是一种重要的化工原料,其摩尔质量为78 gmol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
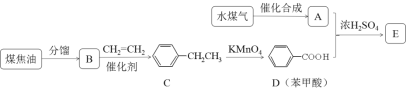
请回答:
(1)化合物A所含的官能团名称是_____________。
(2)B和CH2=CH2反应生成C的反应类型是_____________。
(3)E在氢氧化钠溶液中水解的化学方程式是_____________。
(4)下列说法正确的是_____________。
A.将铜丝在空气中灼烧后迅速插入A中,反应多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为![]()
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol的B 和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾在化工医药、水处理等很多方面有重要应用,可以用电解法制备,装置如下。直流电源采用乙烷—空气的碱性燃料电池。下列说法不正确的是(已知电流效率η=![]() ×100%)
×100%)
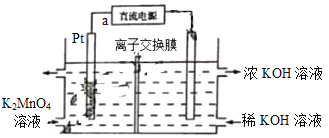
A. 电源负极的电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O
B. 该离子交换膜为阴离子交换膜
C. a极为直流电源的正极
D. 若消耗0.02mo1![]() ,产生0.055mol
,产生0.055mol![]() ,则
,则![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+BmC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1L-1min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1L-1min-1
D.m值为2
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中发生反应: xA(g)+yB(s)![]() zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是( )。
zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是( )。
A.x+y>zB.平衡向正反应方向移动C.B的转化率增大D.C的体积分数下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com