
科目: 来源: 题型:
【题目】按要求作答。
(1)①写出MgO的名称________________;②写出乙炔的结构式______。
(2)写出NaHCO3受热分解的化学方程式______________。
(3)写出Cl2与NaOH溶液反应的离子方程式_____________。
(4)海带中提取碘的过程中,将I-氧化生成I2时,若加入过量的氯水,则Cl2将I2氧化生成HIO3,同时还有一种强酸生成,写出该反应的化学方程____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素![]() 原子序数依次增大,
原子序数依次增大,![]() 同主族且与
同主族且与![]() 处于不同周期,
处于不同周期,![]() 同主族且
同主族且![]() 的原子序数是
的原子序数是![]() 的两倍,以下说法正确的是
的两倍,以下说法正确的是
A.原子半径:![]()
B.由![]() 组成的化合物中可能含共价键
组成的化合物中可能含共价键
C.![]() 元素最高价氧化物对应的水化物的酸性比
元素最高价氧化物对应的水化物的酸性比![]() 强
强
D.![]() 的简单气态氢化物的热稳定性比
的简单气态氢化物的热稳定性比![]() 的弱
的弱
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知元素X和Y的核电荷数都小于18,最外层电子数分别为n和(m-5),次外层分别有(n+2)个和m个电子。甲和乙分别为元素X、Y的最高价氧化物的水化物。
(1)元素名称X为____________________,Y为____________________。
(2)甲的化学式是____________________,乙的化学式是____________________。
(3)甲与乙反应的离子方程式是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。利用下图所示装置(图中夹持仪器略去)进行牙膏样品中碳酸钙的定量测定实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
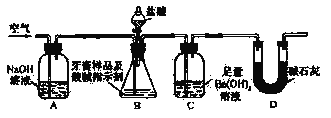
依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:____
(2)C中反应生成BaCO3的化学方程式是__________________。
(3)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_____
(6)上述实验中用到的氢氧化钠以食盐为原料进行生产的。食盐在生产生活中应用广泛,下图是以食盐为原料并综合利用的某些过程如下图所示。
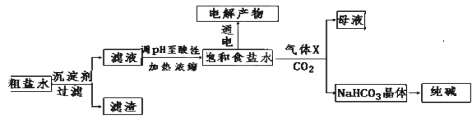
I.除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) __________。
a.Na2CO3 b.NaOH c.BaCl2
II.电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ____________,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是__________。
III.气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是________。
IV.下列有关NaHCO3和纯碱的说法正确的是__________(填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是( )
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=ΔH1-ΔH2
B.ΔH3、ΔH1、ΔH2均为ΔH<0
C.在不同油耗汽车中发生反应③,ΔH3会不同
D.植物的光合作用通过反应①将热能转化为化学能
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氧、氯、镁、镍、铜是几种重要的元素,请回答下列问题:
(1)镍元素的核电荷数为28,则基态原子的电子排布式为____________________,结构中有__________种不同形状的电子云。
(2)MgO的熔点高于CuO的理由是________________________________________。
(3)镁原子第一电离能反常地高于铝的原因是_____________________________。
(4)Ni与CO能形成配合物![]() ,该分子中
,该分子中![]() 键与
键与![]() 键个数比为__________。
键个数比为__________。
(5) ![]() 分子中的中心原子杂化轨道类型是__________,该分子的空间构型为__________。
分子中的中心原子杂化轨道类型是__________,该分子的空间构型为__________。
(6)铜与氧可形成如图所示的晶胞结构,其中铜原子均匀地分散在晶胞内部,a、b原子的坐标参数依次为(0,0,0)、![]() ,则d原子的坐标参数为____________________,已知:该晶体的密度为
,则d原子的坐标参数为____________________,已知:该晶体的密度为![]() ,
, ![]() 是阿伏加德罗常数的值,则晶胞参数为__________cm(列出计算式即可)。
是阿伏加德罗常数的值,则晶胞参数为__________cm(列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等物质中:
等物质中:
(1)只含有离子键的物质是_____________________;
(2)只含有共价键的物质是_______________________;
(3)既含有离子键又含有共价键的物质是_______________________;
(4)属于离子化合物的是______________;
(5)属于共价化合物的是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】补充完成下表:(请把序号①~⑦的答案填在相应的位置上)
元素 | 甲 | 乙 | 丙 |
元素符号 | ①______ | ②______ | O |
原子结构示意图 |
| ③______ | ④______ |
周期 | 三 | 三 | ⑤______ |
族 | ⑥______ | ⅦA | ⑦______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com