
科目: 来源: 题型:
【题目】脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如图:

(1)Ⅳ中官能团的名称___;反应①的反应类型为___。
(2)反应②的化学方程式__。
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式___。
(4)下列说法正确的是___。
A.Ⅰ和Ⅴ均属于芳香烃 B.Ⅱ能发生银镜反应
C.Ⅱ能与4molH2发生加成反应 D.反应③属于酯化反应
(5)A的结构简式__。
(6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式___。
(7)一定条件下,化合物Ⅶ(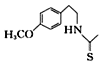 )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式___。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
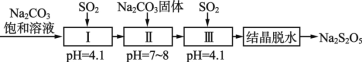
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲胺(CH3NH2)是合成太阳能敏化剂的原料。一定温度下,在三个体积均为2.0 L的恒容密闭容器中按不同方式投入反应物,发生反应CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g),测得有关实验数据如下:
容器编号 | 温度/K | 起始物质的量(mol) | 平衡物质的量mol | ||||
CH3OH | NH3 | CH3NH2 | H2O | CH3NH2 | H2O | ||
I | 530 | 0.40 | 0.40 | 0 | 0 | 0.30 | |
II | 530 | 0.80 | 0.80 | 0 | 0 | ||
III | 500 | 0 | 0 | 0.20 | 0.20 | 0.16 | |
下列说法正确的是( )
A. 正反应的平衡常数K(Ⅰ)=K(Ⅱ)<K(Ⅲ)
B. 达到平衡时,体系中c(CH3OH)关系:2c(CH3OH,Ⅰ)>c(CH3OH,Ⅱ)
D. 530K时,若起始向容器Ⅰ中充入CH3OH 0.10 mol、NH3 0.15 mol、CH3NH2 0.10 mol、H2O 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液,有关微粒的物质的量变化如图,根据图示判断,下列说法错误的是( )
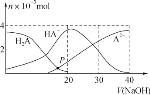
A.在P点时,c(H2A)+c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
B.当V(NaOH)=20 mL时,c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.当V(NaOH)=30 mL时,2c(Na+)=3[c(HA-)+c(A2-)+c(H2A)]
D.当V(NaOH)=40 mL时,c(Na+)>c(A2-)>c(HA-)>c(H2A)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】28g CO气体在1mol的氧气中燃烧后,所得的气体通过足量Na2O2固体中充分反应后,下列说法不正确的是( )
A. CO与氧气反应,只消耗了0.5mol氧气
B. 充分反应后Na2O2固体质量增加了28 g
C. 通过以上两步反应后余下氧气物质的量为0.5mol
D. 若2gH2替代 28g的CO发生上述反应,则Na2O2固体质量增加了2g
查看答案和解析>>
科目: 来源: 题型:
【题目】分子式为![]() 的有机物A有下列变化:
的有机物A有下列变化:

其中B、C的相对分子质量相等,下列有关说法错误的是( )
A.C和E互为同系物
B.符合题目条件的A共有4种
C.D既能发生氧化反应,又能发生还原反应
D.符合题目条件的B共有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.lmolC3H8O分子中含有共价键数目为11NA
B.一定条件下,将2.8gN2与足量氢气充分反应,得到氨气分子数目等于0.2NA
C.标准状况下,22.4LSO2和SO3的混合物,含硫原子的数目为NA
D.15g14C16O中含有的质子数目为8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。回答下列问题:
(1)装置中安全管的作用原理是___。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用___式滴定管,可使用的指示剂为___。
(3)样品中氨的质量分数表达式为___。

(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1,c(CrO42-)为___mol·L-1。
(已知:Ksp(Ag2CrO4)=1.12×10-12)
(6)X的化学为[Co(NH3)6]Cl3。制备X的反应化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
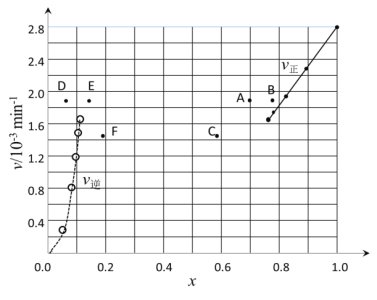
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中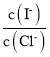 为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g) ΔH=+11kJ·mol-1,
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为___。若起始时n(HI)=100mol,则过程中需吸收的能量为___kJ。
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为___(以K和k正表示)。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为___(填字母)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com