
科目: 来源: 题型:
【题目】某实验小组探究AgNO3溶液与Na2SO3溶液的反应。
实验I | 操作 | 现象 |
| 滴加5滴0.1mol/L Na2SO3溶液,振荡 | 产生白色沉淀,测得混合溶液pH=5 |
继续滴加0.1mol/L Na2SO3溶液,振荡 | 白色沉淀增多,继续滴加,白色沉淀消失,测得混合溶液pH=9 |
资料:Ag2SO3,白色固体,难溶于水;Ag2SO4,白色固体,微溶于水;AgOH,白色固体,常温下不稳定,易分解产生棕褐色固体。
(1)测得0.1mol/L Na2SO3溶液pH=10,用离子方程式解释原因:_______。
(2)实验小组对白色沉淀的成分提出猜想:
①可能含Ag2SO3。
②可能含Ag2SO4,理由是________。
③可能含AgOH。
实验产生的白色沉淀放置一段时间后未发生明显变化,排除猜想③。
(3)检验白色沉淀的成分
(资料:Ag++2S2O32![]() Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
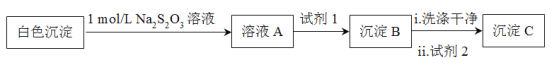
测得沉淀C质量小于沉淀B,试剂1和试剂2分别是_____、______,说明白色沉淀是Ag2SO3和Ag2SO4的混合物。
(4)探究白色沉淀消失的原因。实验小组设计对照实验:
实验II | 实验III | |
实验操作 |
|
|
现象 | 沉淀溶解 |
① 补充实验III的实验操作及现象:_______,证明SO32使白色沉淀溶解。
② 查阅资料:Ag2SO3能溶于过量Na2SO3溶液中形成Ag(SO3)23。白色沉淀中含有g2SO4,但还能全部溶解于Na2SO3溶液的原因是______。
(5)探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应。
实验IV | 操作 | 现象 |
| 步骤i:滴加一定体积0.1 mol/L Na2SO3溶液 | 产生白色沉淀 |
步骤ii:再加入NaOH溶液调pH=14,振荡 | 白色沉淀变黑,经检验为Ag |
步骤ii中Ag2SO3发生反应的离子方程式是_________。
(6)综合实验I和IV,说明AgNO3溶液与Na2SO3溶液的反应类型与_______有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知:

回答下列问题:
(1)B的分子式是___________,C中含有的官能团名称是 ____________。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%,则D的结构简式为___________,⑥的反应类型是________________。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:____________________________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:___________________。
i .含有苯环和![]() 结构
结构
ii.核磁共振氢谱有4组峰,且峰面积之比为3∶2∶2∶1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)________________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备 的合成流程图:_______________________________________
的合成流程图:_______________________________________
合成流程图示例如下:CH2 = CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(含2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
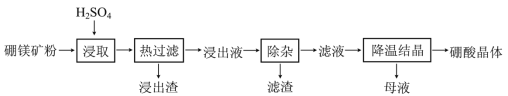
已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0 g、8.7 g、14.8 g、40.2g。Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
(1)“浸取”时主要反应的化学方程式为_____________________。
(2)“浸取”后,采用“热过滤”的目的是___________________________。
(3)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有其他杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是__________。H2O2的作用是______(用离子方程式表示)。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4H2O,应采取的措施是将“母液”蒸发浓缩后,最佳结晶条件是_____________。
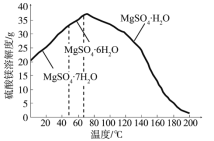
A. 升温结晶 B. 降温结晶 C. 加压升温结晶 D. 降压降温结晶
(5)在实际生产中为了提高原料的综合利用率,可以利用除杂后滤渣作为提炼铝的原料,工艺流程为:
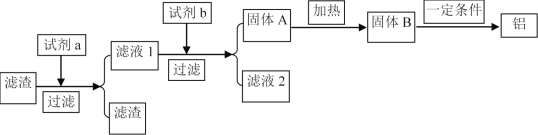
试剂a可选用________(化学式)溶液,若试剂b为AlCl3则由滤液得固体A的离子反应方程式为___________,在实际工业生产中,流程中的一定条件指的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学设计并进行了如下实验,以探究乙炔与溴的加成反应:先取一定量工业用电石与水反应,将生成的气体通入足量的溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色的溶液里有少许黄色浑浊,推测在制得乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中的两个化学方程式:_______________、____________。
(2)乙认为甲设计的实验不能验证此反应为加成反应,其理由是________________。
A.使溴水褪色的物质,就是乙炔
B.使溴水褪色的反应就是加成反应
C.使溴水褪色的物质,未必是乙炔
D.使溴水褪色的反应未必是加成反应
(3)乙同学推测此乙炔中必定含有的一种杂质气体是_________,在验证过程中必须全部除去,它与溴水反应的化学方程式是________________________________________________________。
(4)请你选用下列三个装置(见下图)(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
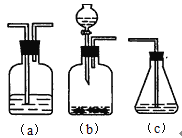
![]()
___、___、___、___
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求填空:
(1)①![]() 的名称为:___;
的名称为:___;
②![]() 的名称为:___;
的名称为:___;
③苯酚与浓溴水反应的化学方程式:___;
④甲醛与新制氢氧化铜悬浊液反应的化学方程式:___。
⑤某有机化合物A的分子式为C5H11Br,分子结构中有三个—CH3,两个![]() ,一个—Br,则A的结构简式为___。
,一个—Br,则A的结构简式为___。
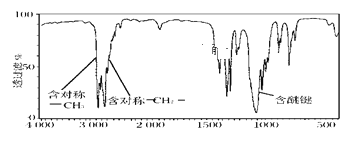
(2)某有机物A的相对分子质量为74,且红外光谱图如图,则A的结构简式为__。
(3)1体积某烃的蒸气完全燃烧生成的CO2比生成的水蒸气少1体积(在同温同压下测定)。0.1mol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39g。该烃的分子式为__;若该烃的一氯代物有3种,写出该烃所有可能的结构简式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B. 香叶醇( )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C. 青蒿素(![]() ) 的一氯代物有5种(不含立体异构)
) 的一氯代物有5种(不含立体异构)
D. 某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】“瘦肉精”是一种能减少脂肪增加瘦肉的药品,有很危险的副作用,轻则导致心律不齐,重则导致心脏病。下列关于两种常见瘦肉精的说法不正确的是( )
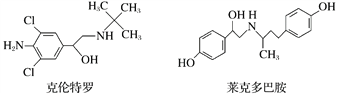
A.克伦特罗分子的分子式为C12H18ON2Cl2
B.克伦特罗能发生加成、氧化、消去等反应
C.克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别
D.莱克多巴胺与足量NaOH溶液反应,生成物的化学式为C18H20NO3Na3
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、W、Q五种元素,它们的核电荷数依次增大,且都小于20,其中X为非金属元素。X和Q属于同一族,它们原子的最外层电子排布式为ns1;Y和W也属于同一族,它们原子的最外层的p能级电子数是s能级电子数的两倍;Z原子最外层上电子数等于W原子最外层上电子数的一半。请回答下列问题:
(1)X、Y可形成一种绿色氧化剂A,则A为__(“极性分子”或“非极性分子”);试写出Cu、稀硫酸与A反应制备CuSO4的离子方程式___。
(2)由这5种元素组成的一种化合物是__(填化学式),该物质主要用途是__,并解释其原理___。
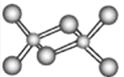
(3)在第四周期中,与Z元素原子未成对电子数相同的金属元素有___种,该元素氯化物的二聚分子结构如图所示,在此化合物中Z原子的杂化类型为___,该化合物在熔融状态下___导电(“能”或“不能”)。
(4)分子WY2、WY3的键角相比,更大的是___(填化学式),写出两种与WY3互为等电子体的微粒___。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用甲醇和水蒸气重整为燃料电池提供氢气。甲醇和水蒸气重整的主要反应是:反应i:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H1= +49 kJ/mol。同时,存在副反应:反应ii:CH3OH(g)
CO2(g)+3H2(g) △H1= +49 kJ/mol。同时,存在副反应:反应ii:CH3OH(g)![]() CO(g)+2H2(g) △H2= +91 kJ/mol
CO(g)+2H2(g) △H2= +91 kJ/mol
(1)反应i的平衡常数K的表达式是_______。
(2)为探究条件对反应i平衡的影响,X、 Y(Y1、Y2)可分别代表压强或温度。下图表示Y一定时,反应i中H2O(g)的平衡转化率随X的变化关系。

① X代表的物理量是_______。
② 判断Y1_______Y2(填“>”或“<”),理由是_______。
(3)CO易使反应i的催化剂中毒,研究温度和投料比对甲醇转化率及重整气中CO物质的量分数的影响,结果如图所示。

①选择250℃、水/甲醇投料比为2作为最佳条件进行反应,原因是_______。
②250℃时CO物质的量分数始终高于200℃时CO物质的量分数的原因可能是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液)。

(1)锥形瓶内装有某种可溶性正盐固体(含有3种酸的酸根的其中一种),此固体为________,分液漏斗中所盛试剂是___。
(2)装置B中所盛试剂的名称是________,试剂的作用是__________。
(3)装置C中出现的现象是__________________。
(4)由实验可知三种酸的酸性大小顺序为________(用化学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com