
科目: 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中
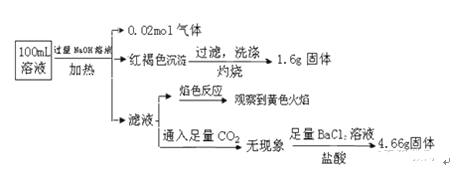
A. 溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2 molL﹣1
B. 原溶液中c(Fe3+)=0.2 molL﹣1
C. SO42﹣、NH4+、Na+一定存在,CO32﹣、Al3+一定不存在
D. 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】铁片镀铜实验中(装置如下图所示),为提高电镀效果,电镀前铁片需依次用NaOH溶液、稀盐酸和水洗涤。下列说法不正确的是
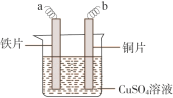
A.稀盐酸的主要作用是除去铁锈
B.a接电源正极,b接电源负极
C.电镀过程中c(Cu2+)基本保持不变
D.阴极发生反应:Cu2++2e– = Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】CO不仅是家用煤气的主要成分,也是重要的化工原料.下图是某些简单有机物在低温低压和催化剂存在下,合成具有优良性能的装饰性高分子涂料粘胶剂的基本过程.已知相间条件下A对氢气的相对密度为14,D具有水果香味且不易溶于水的油状液体.
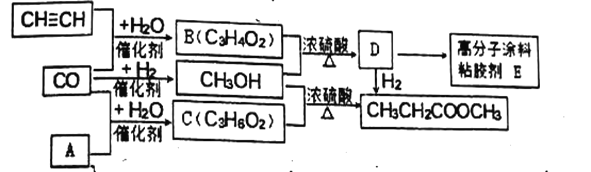
(1)C的结构简式为________;
(2)![]() 的化学方程式为________;
的化学方程式为________;
(3)下列说法正确的是________.
A.D到E的反应类型属于加聚反应
B.A既使溴水溶液褪色,又能使酸性高锰酸钾褪色,且褪色原理相同
C.煤的气化可以得到CO和H2等气体,再经过催化合成可以得到液态烃、甲醇等液体燃料,被称为煤的液化
D.![]() 中含有少量C,可用饱和碳酸钠溶液除去
中含有少量C,可用饱和碳酸钠溶液除去
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是_____(填“Cu”或“Fe”);若Zn、Ag和稀盐酸构成原电池,正极发生_____反应(填“氧化“或还原”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9g。则导线中通过的电子的物质的量是____mol。
(2)肼-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)的能量转化率高。已知:电流效率可用单位质量的燃料提供的电子数表示。肼-空气碱性(KOH为电解质)燃料电池、氨气-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)的电流效率之比为____。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,x为_____。若反应经2min达到平衡,平衡时C的浓度____0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气休总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,x为_____。若反应经2min达到平衡,平衡时C的浓度____0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气休总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业用黄铜矿(主要成分CuFeS2,含少量锌、铅的硫化物)冶炼铜的一种方法如下:
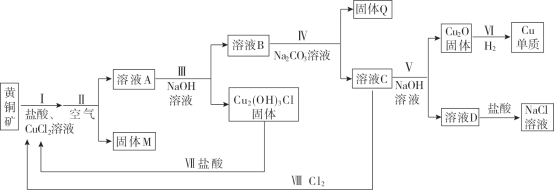
(1)Ⅰ中发生下列反应。ⅰ.CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2Sⅱ. CuCl + Cl-![]() CuCl2-,I中盐酸的作用是________。
CuCl2-,I中盐酸的作用是________。
(2)Ⅱ中通入空气,将Fe2+转化FeOOH沉淀。
①Fe2+转化为FeOOH的离子方程式是__________。
②溶液A中含金属元素的离子有:Zn2+、Pb2+和________。
(3)Ⅲ中需控制NaOH溶液的用量,其原因是________。
(4)Ⅳ中加入Na2CO3溶液的目的是________。
(5)V中反应的离子方程式是________。
(6)从物质循环利用的角度分析,如何处理NaCl溶液才能更好地服务于该冶炼铜的工艺,并说明理由:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是
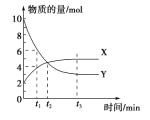
A. 反应的化学方程式为5Y![]() X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
C. t2 时,正、逆反应速率相等 D. t3 时,逆反应速率大于正反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项 | 微粒组 | 所加试剂 | 离子方程式 |
A | NH | 少量Ba(OH)2溶液 | 2NH |
B | Mg2+、Cl-、HCO | 过量NaOH溶液 | Mg2++2HCO |
C | Fe2+、NO | NaHSO4溶液 | HSO |
D | K+、CO | 通入少量CO2 | CO |
查看答案和解析>>
科目: 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
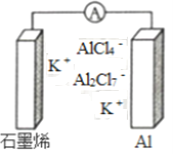
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭容器中发生反应:4A(s)+3B(g)2C(g)+D(g),2min后B减小了1.2mol.有关此反应的说法正确的是( )
A. 在 2min 内的反应速率,用 C 表示是 0.4mol/(Lmin)
B. 分别用 B、C、D 表示化学反应速率其比值是 3:2:1
C. 达到化学反应限度时,B 物质转化率为 100%
D. 向容器中增加 A 的投量,可以加快该反应的速率
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
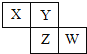
A.Z单质与氢气反应较Y剧烈
B.X与W的原子核外电子数相差9
C.X单质氧化性强于Y单质
D.最高价氧化物对应水化物酸性W比Z强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com