
科目: 来源: 题型:
【题目】25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是( )
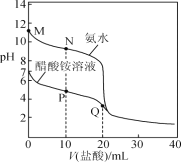
A.M点溶液中:c(OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B.N点溶液中:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点溶液中: c(NH4+)+c(NH3·H2O)<c(CH3COO-) +c(CH3COOH)
D.Q点溶液中:2c(Cl-)=c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组在实验室用如图所示装置制取氨并验证氨的某些性质,请回答。
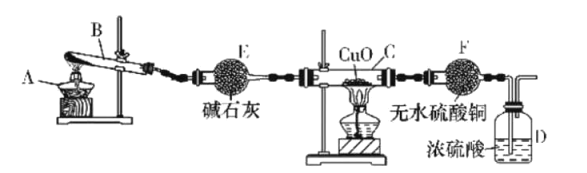
(1)写出此实验中制氨的化学方程式:___。
(2)实验进行一段时间,观察到硬质玻璃管内黑色氧化铜粉末变为红色,盛无水硫酸铜的干燥管内出现蓝色,同时有氮气生成。根据这些现象,写出在硬质玻璃管内发生反应的化学方程式:__,这个反应说明氨具有___(填字母代号)。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(3)装置E的作用是__,装置F的作用是___。E中的碱石灰__(填“能”或“不能”)换成CaCl2。
(4)D中浓硫酸的主要作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是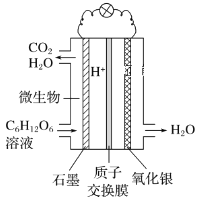
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.每转移4 mol电子,石墨电极产生22.4 L CO2气体
D.每30 g C6H12O6参与反应,有4 mol H+经质子交换膜进入负极区
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组欲探究NO![]() 的氧化性及其还原产物。
的氧化性及其还原产物。
(1)提出问题
甲同学认为只有溶液中同时存在H+时,NO![]() 才有氧化性;
才有氧化性;
乙同学不赞成甲同学观点,他认为NO![]() 自身就具有氧化性,依据是__________
自身就具有氧化性,依据是__________
(2)实验探究:小组同学为解决上述争论,设计并进行了以下实验
实验I | 实验II | 实验III | |
操作 |
|
|
|
现象 | 微热,产生无色气泡,至液面上方变为浅红棕色。用拇指堵住试管口片刻,靠近酒精灯火焰,没有爆鸣声。 | 微热,产生无色气泡,湿润的红色石蕊试纸变蓝。用拇指堵住试管口片刻,靠近酒精灯火焰,没有爆鸣声。 | 微热,产生无色气泡,湿润的红色石蕊试纸变蓝。用拇指堵住试管口片刻,靠近酒精灯火焰,没有爆鸣声。 |
①实验I中反应的离子方程式为_________。
②实验II滴加两滴蒸馏水的目的是__________,产生的无色气泡为___________
③实验III反应后静置,取上层清液,滴加稀盐酸,先产生白色浑浊,后又消失。则实验III中反应的离子方程式为__________。
(3)实验结论:由实验I、II、III可得出的结论是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)。
已知在25℃时:①C(s)+![]() O2(g)
O2(g)![]() CO(g) H4=-111kJ/mol
CO(g) H4=-111kJ/mol
②H2(g)+![]() O2(g)=H2(g) H2=-242kJ/mol
O2(g)=H2(g) H2=-242kJ/mol
③C(s)+O2(g)=CO2(g) H2=-394kJ/mol
下列说法不正确的是( )
A.25℃时,![]()
B.增大压强,反应①的平衡向逆反应方向移,平衡常数K减小
C.反应①达到平衡时,每生成![]() 的同时生成0.5molO2
的同时生成0.5molO2
D.反应②断开2molH2和1molO2中的化学键所吸收的能量比形成4molO-H键所放出的能量少484kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
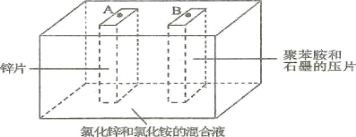
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
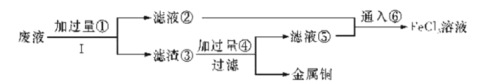
(1)写出下列物质的化学式①___、⑥___。
(2)步骤Ⅰ的操作名称:___。
(3)写出FeCl3溶液与铜发生反应的离子方程式:_______。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为__色沉淀,此过程所涉及反应的化学方程式为:______、___。
(5)通入⑥发生反应的离子方程式:________。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是___(填字母代号)。
A 有铜无铁 B 有铁无铜 C 铁、铜都有 D 铁、铜都无
查看答案和解析>>
科目: 来源: 题型:
【题目】几种物质的能量关系如下图所示。下列说法正确的是
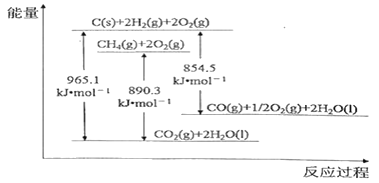
A. C(s)+O2(g)=CO2(g) △H =—965.1 kJ·mol-1
B. 2CO(g)+O2(g)=2CO2(g) △H =-221.2 kJ·mol-1
C. 由图可知,甲烷的燃烧热为779.7 kJ·mol-1
D. 通常由元素最稳定的单质生成生成1mol纯化合物时的反应热称为该化合物的标准生成焓,由图可知,CH4(g)的标准生成焓为+74.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在体积可变的容器中发生反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(l),改变起始时加入各物质的量,在不同压强下达平衡时CH3OCH3(g)的物质的量如表所示,下列说法错误的是( )
CH3OCH3(g)+3H2O(l),改变起始时加入各物质的量,在不同压强下达平衡时CH3OCH3(g)的物质的量如表所示,下列说法错误的是( )
压强 | P1 | P2 | P3 | |
n/mol | ①2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
②1.0molCO2 3.0molH2 | x 1 | y 1 | z 1 | |
③1.0molCH3OCH3 3.0molH2O | x 2 | y 2 | z 2 | |
A.P1>P2B.x 1=0.05
C.P2条件下,③中CH3OCH3平衡转化率为96%D.若该反应可自发进行,则高温更有利
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com