
科目: 来源: 题型:
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:![]()
![]()
![]() 。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
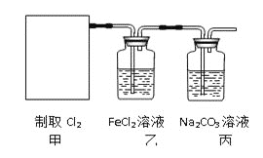
![]() 在该实验中,甲部分的装置是_______
在该实验中,甲部分的装置是_______![]() 填字母
填字母![]() 。
。
![]() 乙装置中
乙装置中![]() 溶液与
溶液与![]() 反应的离子方程式是________________。
反应的离子方程式是________________。
![]() 已知酸性:
已知酸性:![]() ,丙装置中通入少量
,丙装置中通入少量![]() ,可制得具有漂白、消毒的物质,这种物质是_______
,可制得具有漂白、消毒的物质,这种物质是_______![]() 化学式
化学式![]() 。
。
![]() 有人认为该实验存在明显的缺陷,如何改进:______________,请你写出Cl2和“
有人认为该实验存在明显的缺陷,如何改进:______________,请你写出Cl2和“![]() ”中“最合适的化学试剂”反应的离子方程式_________________________。
”中“最合适的化学试剂”反应的离子方程式_________________________。
(3)家庭中常用消毒液![]() 主要成分
主要成分![]() 与洁厕灵
与洁厕灵![]() 主要成分盐酸
主要成分盐酸![]() 清洁卫生。某品牌消毒液包装上说明如下图。
清洁卫生。某品牌消毒液包装上说明如下图。

![]() “与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:__________。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:__________。
![]() 漂粉精
漂粉精![]() 主要成分
主要成分![]() 与消毒液有相同的消毒功效,也需“密封保存”,请用化学方程式解释漂粉精因保存不当而变质失效的原因_________。
与消毒液有相同的消毒功效,也需“密封保存”,请用化学方程式解释漂粉精因保存不当而变质失效的原因_________。
查看答案和解析>>
科目: 来源: 题型:
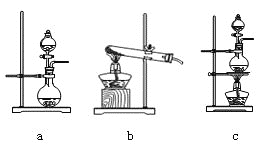
【题目】电导率可用于衡量电解质溶液导电能力的大小。向10mL 0.3 mol·L-1Ba(OH)2溶液滴入0.3 mol·L-1 NH4HSO4溶液,其电导率随滴入的NH4HSO4溶液体积的变化如图所示(忽略BaSO4溶解产生的离子)。下列说法不正确的是
A.a→e的过程水的电离程度逐渐增大
B.b点:c(Ba2+) =0.1 moI.L-1
C.c点:c(NH4+)<c(OH-)
D.d点:c(SO42-)+c(H+)>c(OH-)+c(NH3H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】将氯气持续通入紫色石蕊试液中,溶液颜色呈现如下变化:
![]()
关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是( )
A.H+、ClO-、Cl2B.H+、ClO-、Cl-C.HCl、ClO-、Cl-D.H+、HClO、Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】碲是发展高科技产业、国防与尖端技术不可或缺的原料。H2TeO3是一种比草酸酸性弱的二元酸,工业上常用铜阳极泥[主要成分是碲化亚铜(Cu2Te),含少量的Ag、Au]回收碲,其工艺流程如下:
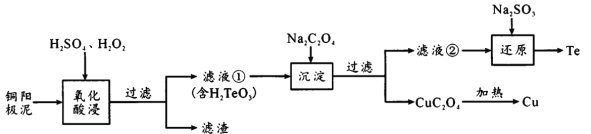
已知:CuC2O4的Ksp为2.2×10-8;离子浓度小于1×10-5mol/L时,即离子完全沉淀。
(1)Cu2Te中Te的化合价是___。
(2)滤渣的成分是___,滤液①中含有的氧化酸浸时氧化产物为____。氧化酸浸时温度过高会使碲的浸出率降低,原因是_______。
(3)若要使Cu2+完全沉淀,应控制C2O42-的浓度不低于_____。
(4)还原反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】不同温度下,三个体积均为1L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
容器编号 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | ||||
CH4 | NO2 | N2 | CO2 | H2O | NO2 | ||
I | T1 | 0.50 | 1.2 | 0 | 0 | 0 | 0.40 |
II | T2 | 0.30 | 0.80 | 0.20 | 0.20 | 0.40 | 0.60 |
III | T3 | 0.40 | 0.70 | 0.70 | 0.70 | 1.0 | |
A.T1<T2
B.若升高温度,正反应速率减小,逆反应速率增大,平衡逆移
C.平衡时,容器I中反应放出的热量为693.6 kJ
D.容器III中反应起始时v 正(CH4) <v逆(CH4)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F代表周期表中五种短周期元素,已知:
![]() 、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
![]() 与C处于周期表中同一周期,
与C处于周期表中同一周期,![]() 中各层电子数都是
中各层电子数都是![]() 个。
个。
![]() 、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
![]() 是半径最小的原子。据此填空下列空白:
是半径最小的原子。据此填空下列空白:
![]() 写出各元素的名称A ______ C ______ E ______
写出各元素的名称A ______ C ______ E ______
![]() 写出A和D形成化合物的电子式 ______
写出A和D形成化合物的电子式 ______
![]() 、C、D三种元素单原子离子的半径由大到小的顺序: ______
、C、D三种元素单原子离子的半径由大到小的顺序: ______
![]() 、B的氢化物的熔沸点大小并写出原因: ______
、B的氢化物的熔沸点大小并写出原因: ______
![]() 写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为_________________。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为_____
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)_________
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是________________________________________
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是____________________________
(6)如图为石墨晶胞结构示意图,该晶胞中含有碳原子的个数为______
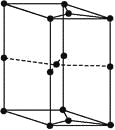
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种锂离子电池,在室温条件下可进行循环充放电,实现对磁性的可逆调控。一极为纳米Fe2O3,另一极为金属锂和石墨的复合材料,电解质只传导锂离子。电池总反应为:Fe2O3+6Li![]() 2Fe+3Li2O,关于此电池,下列说法不正确的是
2Fe+3Li2O,关于此电池,下列说法不正确的是
A.放电时,此电池逐渐靠近磁铁
B.放电时,正极反应为Fe2O3+6Li++6e-= 2Fe+3Li2O
C.放电时,正极质量减小,负极质量增加
D.充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)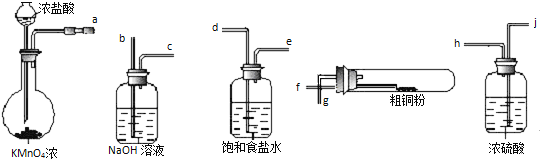
①按气流方向连接各仪器接口顺序是:![]() ______ .
______ .
②反应时,盛粗铜粉的试管中的现象是 ______ .
③已知:氯化铜溶液中有如下转化关系:
![]()
![]()
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 ______ ![]() 填序号
填序号![]() .
.
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入![]() 晶体,溶液变为绿色
晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com