
科目: 来源: 题型:
【题目】(1)①Cu ②CO2 ③H2SO3④H2O⑤液态HCl ⑥H2SO4⑦Ba(OH)2 ⑧NaCl ⑨蔗糖 ⑩NaOH溶液
上述物质中属于电解质的是______________,属于非电解质的是________,能导电的是_________。 (填序号,必须填全,否则不得分)
(2)与16g氧气所含原子总数相同的氨气是_________________g。
(3)已知实验室制取氯气的反应原理为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比为________
②当2 mol MnO2参加反应时转移电子______mol
③当转移1 mol电子时能生成标准状况下的Cl2______L
④浓盐酸在反应中显示出来的性质是______(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
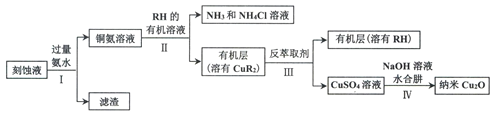
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。CO2与H2合成二甲醚(CH3OCH3)是一种CO2转化方法,其过程中主要发生下列反应:
反应I CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
反应II 2CH3OH(g)![]() CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
反应III CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=41.2 kJ.mol-1
CO(g)+H2O(g) △H3=41.2 kJ.mol-1
(1)写出CO2与H2一步合成二甲醚(反应IV)的热化学反应方程式:_______________
(2)有利于提高反应IV平衡转化率的条件是_______。
A.高温高压 B.低温诋压 C.高温低压 D.低温高压
(3)在恒压、CO2和H2起始物质的量之比为1:3的条件下,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图1。CH3OCH3的选择性=![]()
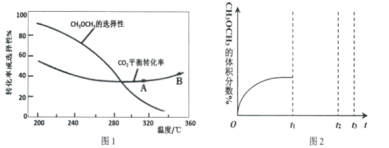
①温度低于300℃,CO2平衡转化率随温度升高而下降的原因是_____________________
②关于合成二甲醚工艺的理解,下列说法正确的是_____________
A.反应IV在A点和B点时的化学平衡常数K(A)小于K(B)
B.当温度、压强一定时,在原料气(CO2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低
D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
③在某温度下,若加入CO2的物质的量为1mol,生成二甲醚的选择性为80%,现收集到0.2mol的二甲醚,则CO2转化率为__________________
④一定温度压强下,二甲醚的体积分数随时间变化如图2所示。在t1时刻,再加入物质的量之比为1:3的CO2和H2,t2时刻重新达到平衡。画出t1—t3时刻二甲醚体积分数的变化趋势。__________________
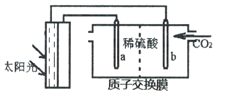
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图所示,则b极的电极反应式为____________________
查看答案和解析>>
科目: 来源: 题型:
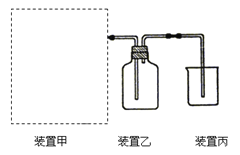
【题目】(1)下图为实验室制备、收集少量HCl的装置。
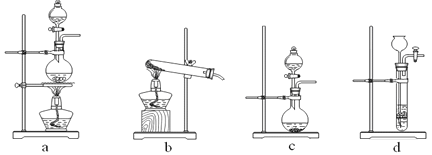
① 制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。
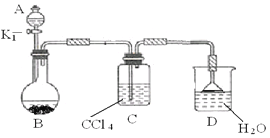
①按上图所示的装置图连接好各仪器。
②检验装置的气密性。
③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。装置C的作用是 。
④反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。其中试剂为 ,操作名称为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列各题。
(1)向澄清石灰水中通入过量CO2(写出离子方程式)___________________________________
(2)用稀硫酸洗铁锈(Fe2O3)(写出离子方程式)____________________________________
(3)2Al + 6H+ = 2Al3+ + 3H2↑(写出对应的化学方程式并用双线桥法标出电子转移情况)__________________
(4)在一定条件下,某化合物W受热分解:2W ![]() A↑+2B↑+4C↑,测得反应后生成的混合气体的密度是相同条件下H2密度的12倍,则W的摩尔质量是 _______
A↑+2B↑+4C↑,测得反应后生成的混合气体的密度是相同条件下H2密度的12倍,则W的摩尔质量是 _______
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子反应,表达正确的是( )
A. 向KHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:2H+ + SO42-+ Ba2+ + 2OH-= BaSO4↓ + 2H2O
B. CaCO3与醋酸反应:CaCO3 + 2H+=Ca2+ + CO2↑+ H2O
C. 向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3—+2OH— =CaCO3↓+CO32—+2H2O
D. MgSO4溶液跟Ba(OH)2溶液反应:SO42― + Ba2+=BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体![]() 。
。
Ⅰ![]() (查阅资料)
(查阅资料)
(1)![]() 是无色透明晶体,易溶于水,其稀溶液与
是无色透明晶体,易溶于水,其稀溶液与![]() 溶液混合无沉淀生成。
溶液混合无沉淀生成。
(2)向![]() 和
和![]() 混合溶液中通入
混合溶液中通入![]() 可制得
可制得![]() ,所得产品常含有少量
,所得产品常含有少量![]() 和
和![]() 。
。
(3)![]() 易被氧化;
易被氧化;![]() 难溶于水,可溶于稀盐酸。
难溶于水,可溶于稀盐酸。
Ⅱ![]() (制备产品)
(制备产品)
实验装置如图所示![]() 省略夹持装置
省略夹持装置![]() :
:

实验步骤:
(1)检查装置A、B气密性的方法是______,如图示加入试剂。仪器b的名称是______;E中的试剂是______![]() 选填下列字母编号
选填下列字母编号![]()
A.稀![]()
B.饱和![]() 溶液
溶液
C.饱和![]() 溶液
溶液
D.NaOH溶液
(2)先向C中烧瓶加入![]() 和
和![]() 的混合溶液,再向A中烧瓶滴加浓
的混合溶液,再向A中烧瓶滴加浓![]() 。
。
(3)待![]() 和
和![]() 完全消耗后,结束反应。过滤C中的混合物,滤液经蒸发、结晶、过滤、______、干燥、得到产品
完全消耗后,结束反应。过滤C中的混合物,滤液经蒸发、结晶、过滤、______、干燥、得到产品![]() 填写操作名称
填写操作名称![]() 。
。
Ⅲ![]() (探究与反思)
(探究与反思)
(1)为验证产品中含有![]() 和
和![]() ,该小组设计了以下实验方案,请将方案补充完整
,该小组设计了以下实验方案,请将方案补充完整![]() 所需试剂从稀
所需试剂从稀![]() 、稀
、稀![]() 、稀盐酸、蒸馏水中选择
、稀盐酸、蒸馏水中选择![]() .取适量产品配成稀溶液,滴加足量
.取适量产品配成稀溶液,滴加足量![]() 溶液,有白色沉淀生成,______,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有
溶液,有白色沉淀生成,______,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有![]() 和
和![]() 。
。
(2)为减少装置C中生成![]() 的量,在不改变原有装置的基础上对实验步骤
的量,在不改变原有装置的基础上对实验步骤![]() 进行了改进,改进后的操作是______。
进行了改进,改进后的操作是______。
(3)![]() 的溶解度随温度升高显著增大,所得产品通过______方法提纯。
的溶解度随温度升高显著增大,所得产品通过______方法提纯。
查看答案和解析>>
科目: 来源: 题型:
【题目】由下列实验及现象能推出相应结论的是
实验操作及实验现象 | 结 论 | |
A | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应[FeCl3+ 3KSCN |
B | 向做了相同标记的2支试管中均加入2mL 0.1mol/L Na2S2O3溶液,再分别向2支试管中加入4mL浓度为0.1mol/L、0.5mol/L 的H2SO4溶液,测定恰好遮挡全部标记所用时间 | 其他条件一定时,反应物浓度越大,化学反应速率越快 |
C | 室温下,用广泛pH试纸测定0.1 mol/L Na2SO3溶液的pH为10,0.1mol/L NaHSO3溶液的pH为5 | 相同条件下,HSO3-的水解能力强于SO32- |
D | 向2 mL0.1mol/LAgNO3溶液中加入1mL0.1mol/LNaCl溶液,生成白色沉淀,再加入1mL0.1mol/L KI溶液,生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00molCO2和2.0 mol H2以及催化剂发生反应:CO2(g)+H2 (g)![]() HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
60 min | 90 min | 120 min | 150 min | 180 min | ||
实验I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
实验Ⅱ | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)比较实验温度T1___T2(填“>”、“<”),该反应的ΔH___0(填“>”、“=”、“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为_____。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=___。
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl___vⅡ(填“>”、“<”或“无法判断”),原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com