
科目: 来源: 题型:
【题目】煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)![]() CaO(s) + CO2(g) △H1= +178.30kJ/mol
CaO(s) + CO2(g) △H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)![]() CaSO4(s) △H2= -501.92 kJ/mol
CaSO4(s) △H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g) ![]() CO2(g) △H3
CO2(g) △H3
④CaSO4(s) + CO(g) ![]() CaO(s) + SO2(g) + CO2(g) △H4= +218.92kJ/mol
CaO(s) + SO2(g) + CO2(g) △H4= +218.92kJ/mol
(1)温度升高,反应①的化学平衡常数________(填“增大”“减小”或“不变”)。
(2)△H3=________kJ/mol。
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯苯是一种重要的有机合成原料,用氯苯合成染料中间体F的两条路线如下图所示。
路线1: 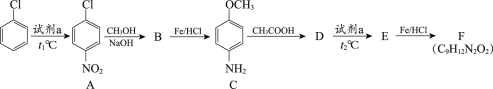
路线2: 
(1)试剂a为________。
(2)A→B的反应类型为取代反应,该反应的化学方程式为________。
(3)B→C的反应类型为________。
(4)C与CH3COOH的相对分子质量之和比D的相对分子质量大18,D→E的取代反应发生在甲氧基(—OCH3)的邻位,F的结构简式为________。
(5)G的结构简式为________。
(6)有机物I与对苯二甲酸(![]() )发生聚合反应的化学方程式为_____。
)发生聚合反应的化学方程式为_____。
(7)I与CH3COOH反应生成的有机产物除F外,还可能有________(写出结构简式)。
(8)满足下列条件的C的同分异构体有________种。①与FeCl3溶液发生显色反应②分子中含有—NH2③苯环上有3种氢
查看答案和解析>>
科目: 来源: 题型:
【题目】迄今为止,煤不但是人类使用的主要能源,也是重要的化工原料。如图是以煤为原料合成聚苯乙烯塑料的流程。
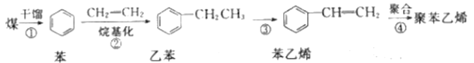
(1)苯在一定条件与Cl2反应可生成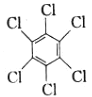 ,该反应类型为___(填“取代”或“加成”)反应;
,该反应类型为___(填“取代”或“加成”)反应;
(2)如图流程中原子利用率为100%的反应是___(填字母);
A.①③ B.②④
(3)能使酸性高锰酸钾溶液褪色的是___(填“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如下图所示。

(1)上图所示氮循环中,属于氮的固定的有________(填字母序号)。
a. N2转化为氨态氮 b. 硝化过程 c. 反硝化过程
(2)氮肥是水体中氨态氮的主要来源之一。
①氨气是生产氮肥的主要原料,工业合成氨的化学方程式为________。
②检验氨态氮肥中NH4+的实验方案是________。
(3)硝化过程中,含氮物质发生________(填“氧化”或“还原”)反应。
(4)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol氮气时,转移的电子的物质的量为________ mol。
(5)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式分别说明利用土壤中的铁循环脱除水体中氨态氮和硝态氮的原理:________、________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用固体烧碱配制0.5mol/L的NaOH溶液490mL,用质量分数为98%,密度为1.84 g/cm3的浓硫酸配制0.6mol/L的硫酸溶液500mL。请回答下列问题:
(1)计算需要NaOH固体质量_________ g。
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒。配制以上两种溶液必须使用的玻璃仪器_________(填序号),还缺少的仪器是_________。
(3)定容的具体操作方法是:________
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用__________ mL量筒最好。
(5)配制过程中,下列操作会引起结果偏高的是__________(填序号)
①未洗涤烧杯、玻璃棒
②称量NaOH的时间太长
③定容时俯视刻度
④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶
⑥量取浓硫酸时,仰视量筒刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
(1)第①步中,操作A是________,第⑤步中,操作B用到的玻璃仪器是________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_________。
(4)判断BaCl2已过量的方法是___________。
(5)下列是某学生设计操作A后混合液中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验_________离子,应先加入过量的_____________。
②将所得混合物_________(填操作名称),然后在滤液中加入试剂_________检验另一离子。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
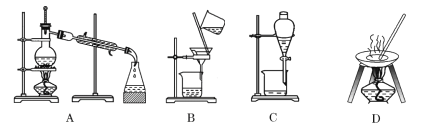
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙__________;
(2)氯化钠溶液中分离出氯化钠___________;
(3)分离39%的乙醇溶液___________;
(4)分离溴的氯化钠溶液____________;
Ⅱ.利用“化学计量在实验中的应用”的相关知识进行填空
已知某饱和氯化钠溶液体积为VmL,溶液密度为d g/cm3,质量分数为w,物质的量浓度为c mol/L,溶液中含NaCl的质量为m g。
(1)用m、V表示溶液的物质的量浓度是_________
(2)用w、d表示溶液的物质的量浓度是_________
(3)用c、d表示溶液的质量分数是__________
查看答案和解析>>
科目: 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是
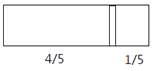
A.右边CO和CO2分子数之比为1:3
B.右边CO的质量为14g
C.右边气体密度是相同条件下氧气密度的2倍
D.若改变右边CO和CO2的充入量而使隔板处于距离右端1/3 处,若保持温度不变,则前后两次容器内的压强之比为5:6
查看答案和解析>>
科目: 来源: 题型:
【题目】C60可用作储存氢气的材料,结构如右图所示。继C60后,科学家又合成了Si60、N60,三种物质结构相似。下列有关说法正确的是
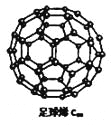
A.C60、Si60、N60都属于原子晶体
B.C60、Si60、N60分子内共用电子对数目相同
C.由于![]() 键能小于
键能小于![]() ,故N60的稳定性弱于N2
,故N60的稳定性弱于N2
D.由于![]() 键长小于
键长小于![]() 键,所以C60熔、沸点低于Si60
键,所以C60熔、沸点低于Si60
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学以废旧铝制易拉罐为原料制备Al(OH)3其流程如图:
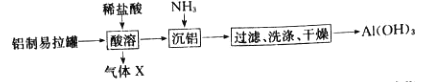
(1)“酸溶”时,增大盐酸的浓度反应速率将___(填“增大”或“减小”)。
(2)气体X是___(填“H2”或“CO2”)。
(3)一定条件下,将1molN2和3molH2置于lL密闭容器中合成NH3,10min后测得H2为l.2mol,则用H2表示该反应的速率为___molL-1min-1。
(4)氢氧化铝是___(从性质上分类)氢氧化物,它与盐酸反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com