
科目: 来源: 题型:
【题目】以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。四种盐在不同温度下的溶解度表 (g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | — | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为________________;
②加料完毕,保温30分钟,目的_________;
③过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使_________________(填化学式)循环使用,回收得到NH4Cl晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于硝酸的说法不正确的是( )
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.滴定前平视读数,滴定后仰视读数
B.滴定结束后,滴定管尖嘴处有一悬挂液滴
C.取NaOH溶液时先平视读数,后仰视读数
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2次~3次
查看答案和解析>>
科目: 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为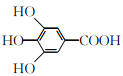 ,下列关于没食子酸的说法正确的是( )
,下列关于没食子酸的说法正确的是( )
A.分子式为C7H7O5
B.能发生加成反应,消去反应和取代反应
C.1 mol没食子酸与足量的钠反应,生成2 mol H2
D.1 mol没食子酸与足量的碳酸氢钠反应,生成4 mol CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 25℃水的电离常数是1.0×1014
B. 中性溶液的c(H+)=![]()
C. 纯水在100℃时,c(H+)>107mol·L1,所以此时纯水中c(H+)>c(OH)
D. pH<7的溶液一定是酸溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】异丙烯苯和异丙苯是重要的化工原料,二者存在如下转化关系: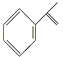 +H2
+H2![]()
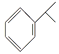 下列说法中正确的是( )
下列说法中正确的是( )
A. 异丙烯苯与苯互为同系物
B. 异丙烯苯不能发生取代反应
C. 异丙苯的一溴代物有5种
D. 0.5 mol异丙苯完全燃烧消耗氧气5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】氮有多种化合价,能形成多种化合物。工业上用活性炭还原法处理NO,有关反应为:C(s) + 2NO(g)![]() N2(g) + CO2(g)。向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应。
N2(g) + CO2(g)。向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应。
(1)若2min内气体密度增大了1.2 g/L,则氮气的平均反应速率为___________mol/(L· min)。
(2)该化学平衡常数表达式K =__________________,已知升高温度时,K增大,则正反应为______(填“吸热”或“放热”)反应。
(3)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是____________。
(4)下列各项能判断该反应达到平衡的是____________________(填序号字母)。
a.容器内压强保持不变 b.2v正(NO)=v逆(N2)
c.混合气体的平均分子质量不变 d.混合气体的密度保持不变
(5)已知NaNO2溶液呈碱性,则NaNO2溶液中离子浓度由大到小的顺序是_______________。
(6)在催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式:____________,其中被氧化的元素____ ,该反应中氧化产物与还原产物的物质的量之比是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
A. l mol OH﹣所含电子数为10NA
B. 2L0.5 molL﹣1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 标准状况下,1.12 L CC14含有的氯原子数为0.2NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com