
科目: 来源: 题型:
【题目】(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“” ___。
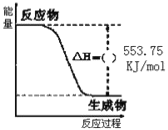
②写出表示丙烷燃烧热的热化学方程式:___。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为___。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)═H2O(l) △H1=Q1kJ/mol
C2H5OH(g)═C2H5OH(l) △H2=Q2kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g) △H3=Q3kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+![]() O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
查看答案和解析>>
科目: 来源: 题型:
【题目】任何物质的水溶液都存在水的电离平衡,其电离方程式可表示为:H2OH++OH-。请回答下列有关问题:
(1)现欲使水的电离平衡向右移动,且所得溶液呈酸性,可以选择的方法有_________。
A.加热至100℃ B.加入 NaHSO4(s) C.加入CH3COONa(s) D.加入NH4Cl(s)
(2)在t℃时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积为_____,此温度____25℃(选填“大于”“小于”或“等于”),理由是________。
(3)在25℃时,将pH=a的NaOH溶液VaL与pH=b的HCl溶液VbL混合,请填写下列空白:
①若所得溶液呈中性,且a=11,b=3,则Va:Vb=__________。
②若所得溶液呈中性,且Va:Vb=10:1,则a+b=__________。
③若所得混合溶液的pH=10,且a=12,b=2,则 Va: Vb=___________。
④若将pH=12的NaOH溶液VaL与VbL水混合后所得溶液的pH=10,则Va:Vb=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列各题:
(1)写出电子式NH4Cl _______ ,它的阳离子价层电子对对数为______,该离子空间构型为_______。
(2)周期表一共18列,第四周期第11列元素A,表示A所在族的符号为_________,它的基态原子结构示意图为_____,A+离子的价层电子排布图为____________,A2+离子的价层电子排布式为_____________,A+离子和A2+离子较稳定的是(填离子符号)_______,原因________________________。
(3)乙炔和乙烯分子,它们的σ键个数之比为______,乙烯分子中C原子杂化方式为________,C、N、O三种原子第一电离能从大到小排列____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1molA与1molB混合于1L的密闭容器中,发生如下反应:2A(g)+3B(g) ![]() 2C(g)+zD(g),2s后A 的转化率为 50%,测得v(D)=0.25 mol/(Ls),下列推断不正确的是
2C(g)+zD(g),2s后A 的转化率为 50%,测得v(D)=0.25 mol/(Ls),下列推断不正确的是
A. z=2 B. 2s时,容器内的压强是初始的7/8倍
C. 2s 时C的体积分数为2/7 D. 2s时,B的浓度为0.5mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是
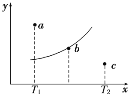
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点:v(正)<v(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应: A(g)+xB(g)![]() 2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A. 平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B. x值等于3
C. A的转化率为20%
D. B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目: 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
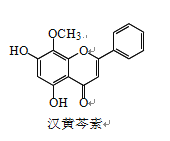
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
(1)基态N原子的价电子占据的能量最高的能级是___,价电子在该能级上的排布遵循的原则是__。
(2)除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等物质。而高聚氮结构具有空间网状结构,如图一所示,则N70的沸点___![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 高聚氮的沸点,原因是___;
高聚氮的沸点,原因是___;
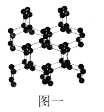
(3)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。与全氮阴离子互为等电子体的一种非极性分子的结构式为___。叠氮化物能形成多种配合物,在[CO(N3)(NH3)5]SO4,其中钴原子的配体是___,SO42-的立体构型为___。
(4)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO3
B.N2H4分子中N原子均采取sp3杂化
C.NaN3的晶格能大于KN3的晶格能
D.纯叠氮酸HN3在常温下是一种液体,是因为分子中存在一种特殊的化学键-氢键
(5)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V形,每个氮原子均达到8电子稳定结构,则阳离子的电子式为___。
(6)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为__。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com