
科目: 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
B.合成氨工业用铁触媒作催化剂
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数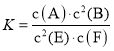 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下图装置中的叙述正确的是
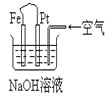
A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色
C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-l
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-l
则2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=____kJ·mol-l。
(2)一定温度下,向体积为 1 L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1 mol,n(NO)=0.2 mol,n(N2)= a mol,且N2占平衡总体积的![]() 。
。
①则该反应的平衡常数K=______。若保持温度及容器体积不变,平衡后在此基础上再向容器中充入3a mol的N2、0.2 mol的NO,平衡将______移动(填“向左”、“向右”或“不”)。
②下列各种情况,可说明该反应已经达到平衡的是______。
A.v生成(CO2)= v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
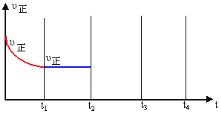
③在t2时刻,将容器迅速压缩到原容积的![]() ,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
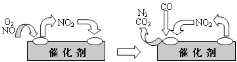
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出上述变化中的总化学反应方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。
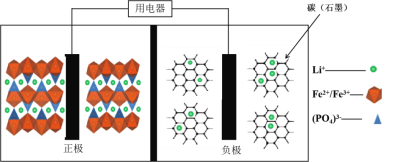
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.小苏打溶液中滴入氢氧化钠溶液:HCO3—+OH—= H2O+CO2↑
B.电解饱和食盐水:2Cl-+ 2H+ ![]() H2↑+ Cl2↑
H2↑+ Cl2↑
C.三氯化铁溶液中滴入过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2+ + 2H+ + H2O2=Fe3+ + 2H2O
查看答案和解析>>
科目: 来源: 题型:
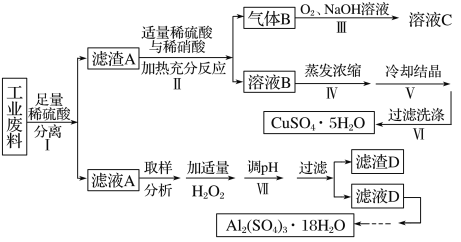
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
请回答:
(1)写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式______。
(2)步骤Ⅳ蒸发浓缩的具体操作是________。
(3)下列有关实验说法正确的是________。(填编号)
A.减压过滤使用的滤纸,为确保把所有的孔都覆盖住,应使滤纸大于布氏漏斗内径
B.为得到纯净的硫酸铝晶体,采用加热烘干的方式干燥
C.步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D.步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可投入几粒晶种并减缓溶液冷却速度
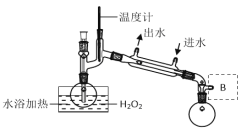
(4)H2O2浓度对反应速率有影响。通过下图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备,该设备的作用是____。
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸—醋酸铵缓冲溶液,再加入过量的c1mol·L-1EDTA溶液V1mL,充分反应后稀释至250 mL。
步骤二:取25.00 mL上述稀释液,滴加指示剂,用c2mol·L-1ZnCl2溶液滴定过量的EDTA,达到终点时消耗V2mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666 g·mol -1,EDTA分别能与Al3+或Zn2+以物质的量之比1∶1进行反应。
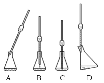
①在步骤二取上述稀释液25.00 mL于锥形瓶中,有下图所示操作(手持部分省略),其中正确的是____。(填编号)取溶液所用仪器的名称是____
②根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为____(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的有( )
①C(s)+O2(g)═CO2(g) △H1 C(s)+![]() O2(g)═CO(g) △H2
O2(g)═CO(g) △H2
②S(s)+O2(g)═SO2(g) △H3 S(g)+O2(g)═SO2(g) △H4
③2H2(g)+O2(g)═2H2O(l) △H5 2H2(g)+O2(g)═2H2O(g) △H6
④CaCO3(s)═CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)═Ca(OH)2(s) △H8
⑤![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH10
Na2SO4(aq)+H2O(l) ΔH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH10
⑥N2O4(g)![]() 2NO2(g) △H11 2NO2(g)
2NO2(g) △H11 2NO2(g)![]() N2O4(g) △H12
N2O4(g) △H12
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】2008年5月17日新疆电视台(午间新闻)报道:我国新增阿勒泰大气背景监测点。这标志着气候条件独特、空气质量优良的新疆阿勒泰市已成为我国第8个国家大气背景监测点。监测点安装的监测设备可监测日常二氧化硫、二氧化氮、一氧化氮等污染物。NO分子因污染空气而臭名昭著,近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于________(填编号)。
A.破坏臭氧层
B.高温下能使一些金属氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO![]() )可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________________________。
)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________________________。
(3)“绿色奥运”是2008年北京奥运会的主题之一,为迎接奥运,减少空气污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳和一氧化氮转化为参与大气循环的无毒混合气体,该气体是(______)
A.二氧化碳和氮气 B.二氧化碳和二氧化氮
C.二氧化碳和氧气 D.二氧化碳和氢气
(4)氟利昂(如CCl2F2)可在光的作用下分解,产生氯原子,氯原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应如下:
O3![]() O2+O Cl+O3=ClO+O2 ClO+O=Cl+O2 总反应:2O3===3O2
O2+O Cl+O3=ClO+O2 ClO+O=Cl+O2 总反应:2O3===3O2
在上述臭氧变成氧气的过程中,Cl是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com