
科目: 来源: 题型:
【题目】将 4 molA 和 2 molB 在 2 L 的容器中混合并在一定条件下发生如下反应 2A(g)+B(s)=2C(g),若经2s后测得 C 的浓度为 0.6 mol/L,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)
②用物质 B 表示的反应的平均速率为 0.6 mol/(L·s)
③增大 B 的浓度可加快反应速率
④2 s 时物质 A 的浓度为 1.4 mol/L
其中正确的是
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铵具有广泛用途,可用于选矿、医药等。
(1)实验室用氯化铵与熟石灰反应制取氨气的化学方程式为____,收集氨气时,可选用下图中的装置____(填字母)。
A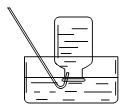 B
B C
C![]()
(2)工业上为提高氯化铵产品的经济利用价值,常利用氢氧化镁和氯化铵共热制得氨气、碱式氯化镁[Mg(OH)Cl](520℃发生分解)。实验室模拟该工艺的装置图如下:

①冷凝管进水口是_____(填“a”或“b”)。
②实验中持续通入氮气的目的是_____。
③共热时,温度不宜过高的原因是_____。
④共热时,若氯化铵用量过大会导致Mg(OH)Cl中混有较多的杂质为_____(写化学式)。
(3)已知氧化钙与氯化铵溶液反应制备氯化钙的适宜温度为80℃。补充完整由氧化钙(含少量SiO2)、氯化铵溶液制备医用CaCl2·2H2O晶体的实验步骤:将氯化铵溶液、氧化钙粉末按照一定配比加入反应器中,_____,得到CaCl2溶液,_____、趁热过滤、洗涤、干燥。(实验中须使用的试剂:稀硫酸)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中,既能因发生化学反应而使溴水褪色,又能使高锰酸钾酸性溶液褪色的是( )
①CH3CH2CH2CH3 ②CH3CH2CH===CH2

A.①②③④ B.②③④
C.②④ D.只有②
查看答案和解析>>
科目: 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为_________________________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________________________________________。
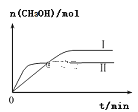
(3)①CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为______________________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是______________。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
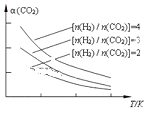
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如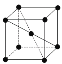 所示,1183 K以上转变为
所示,1183 K以上转变为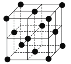 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向0.1molL-1NaA溶液中逐滴滴加盐酸,测得混合溶液的pH与p![]() 变化关系如图所示[p
变化关系如图所示[p![]() =-lg
=-lg![]() ]。下列说法正确的是( )
]。下列说法正确的是( )
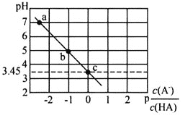
A.a点溶液中c(Na+)=c(A-)
B.电离常数K(HA)的数量级为10-4
C.滴加过程中![]() 不断减小
不断减小
D.b点溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界中氯化钠是由1123Na 与1735Cl 和1735Cl所构成的。已知氯元素的相对原子质量是35.5,则 11.7g 氯化钠中,含1735Cl 的质量为
A.1.75gB.1.85gC.5.25gD.5.55g
查看答案和解析>>
科目: 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。
(1)氨气属于共价型氢化物,工业常用氨气和醋酸二氨合铜[Cu(NH3)2]Ac的混合液来吸收CO(醋酸根离子简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3CO]Ac
①氨水溶液中各元素原子的第一电离能从大到小排列顺序为___________。
②醋酸分子(CH3COOH)中的两个碳原子的杂化方式分别是_________________。
③生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________(填序号)。
A.离子键b.金属键c.共价键d.配位键
(2)某离子化合物XY2,晶胞结构如图所示,其中6个Y原子用数字1~6标注。
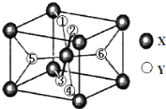
已知1、2、3、4号Y原子在晶胞上、下面上,则5、6号Y原子均在晶胞_________(填“侧面”或“内部”)。
②根据以上信息可以推知,XY2晶体的熔沸点______(填“>”、“=”或“<”)固态氨的熔沸点。
③若该晶胞的边长为anm,密度为ρg/cm3,XY2的摩尔质量为Mg/mol,则阿伏加德罗常数为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D四种元素原子半径由小到大的顺序为_______________________。
(2)A、F形成某种化合物的晶胞结构如下图(其中A显-3价),则其化学式为___(每个球均表示1个原子)。
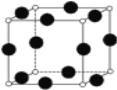
(3)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为________,其晶体类型为_______,晶体中1个A原子周围最近距离且等距离的C原子数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com