
科目: 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料。
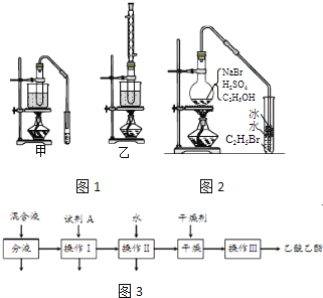
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______。
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是_____(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______。(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲、乙两套装置如图1都可以选用。关于这两套装置的说法正确的是______。(选填编号)

a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物。
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇。
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色。与方案①相比较,方案②的明显缺点是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】喷泉是一种常见的自然现象,其产生原因是存在压强差。
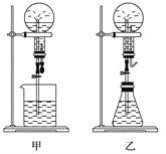
(1)图甲中,为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。
①下列组合中不可能形成喷泉的是(______)。
A.HCl和H2O B.O2和H2O C.NH3和H2O D.CO2和NaOH溶液 E.NO2和H2O
②若用D组合做喷泉实验,烧杯中的液体一定是NaOH溶液吗________?
③用A组合做喷泉实验时,若烧瓶中充满HCl气体,则在标准状况下,做完实验后烧瓶中c(HCl)=________mol·L-1(设溶质不扩散)。
④若用E组合做喷泉实验时,则标准状况下,做完实验后烧瓶中溶质的物质的量浓度是________mol·L-1。
(2)某学生积极思考产生喷泉的其他办法,并设计了如图乙所示的装置。
①在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是(______)
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
这种方法产生喷泉的原理是__________________。
②在图乙锥形瓶外放一水槽,瓶中加入酒精,水槽中加入水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是________这种方法产生喷泉的原理是_____________________________________________________。
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
③比较图甲和图乙两套装置,从产生喷泉的原理来分析,图甲________上部烧瓶内气体压强;图乙________下部锥形瓶内气体压强(填“增大”或“减小”)。
(3)城市中常见的人造喷泉及火山爆发的原理与上述________(填“图甲”或“图乙”)装置的原理相似。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)E在元素周期表中的位置是____________。A与E组成的化合物是常用的溶剂,写出其电子式__________________
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)____________。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为______。
(4)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为______________。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在加热、催化剤作用下2SO2(g)+O2(g)![]() 2SO3(g)下列说法不正确的是( )
2SO3(g)下列说法不正确的是( )
A.在相同条件下,该反应中分别用SO2和O2表示的v,数值不同,但该反应的快慢程度是一致的
B.该反应加入催化剂的目的是为了加快反应速率
C.为了提高SO2的转化率,减少污染物的排放,常常在实际生产中,O2和SO2的投入量之比大于1:2
D.在密闭容器中,投入2 mol SO2和l mol O2,反应结束时生成的2 mol SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图可以从不同角度研究含铁物质的性质及其转化关系。图中甲~己均含铁元素。回答下列问题:

(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析是因其具有____性;下列关于乙的说法正确的是______(填标号)。
a.属于酸性氧化物,能与碱反应
b.属于碱性氧化物,能与酸反应
c.属于两性氧化物,既能与酸反应,又能与碱反应
(2)已知甲与稀硝酸反应的化学方程式为甲+HNO3―→戊+己+NO↑+H2O(方程式未配平)。若产物中戊和己的物质的量之比为3∶1,则甲与HNO3的物质的量之比为____。
(3)戊与烧碱溶液反应生成丙,放置一段时间后丙转化为丁,丙转化为丁的化学方程式为______,现象为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与科学研究、工农业生产、环境保护、日常生活等方面有广泛联系。下列有关说法中正确的是
A.石灰石可用于炼铁、制水泥、制玻璃
B.使用苯代替酒精擦拭手机屏幕
C.同位素示踪法、红外光谱法都是科学家经常使用的研究化学反应历程的手段之一
D.针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学的核心
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20.00mL0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000 mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法不正确的是
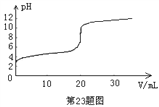
A. 在反应过程中,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
B. pH=5时,c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
C. pH=6时,c(Na+)+ c(H+)-c(OH-)+ c(CH3COOH)=0.1000 mol·Lˉ1
D. pH=7时,消耗NaOH溶液的体积小于20.00mL
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
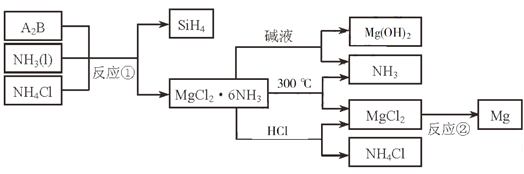
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
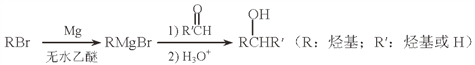
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产.下列对于反应 2SO2+O2 ![]() 2SO3的说法中正确的是( )
2SO3的说法中正确的是( )
A. 只要选择适宜的条件,SO2和O2就能全部转化为SO3
B. 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
C. 该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
D. 在达到平衡的体系中,充入由18O原子组成的O2后,18O仅存在于SO2和SO3中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com