
科目: 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是![]()
![]()
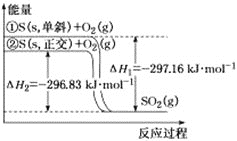
A.![]() ,单斜
,单斜![]() ,正交
,正交![]()
B.等质量的单斜硫和正交硫分别完全燃烧,前者放出的热量更多
C.相同物质的量的正交硫比单斜硫所含有的能量高,正交硫比单斜硫稳定
D.![]() 表示断裂
表示断裂![]() 中的共价键所吸收的能量比形成
中的共价键所吸收的能量比形成![]() 中的共价键所放出的能量少
中的共价键所放出的能量少 ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】a-Fe(III)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为①H2 (g)=2H(g) △H1,②N2(g)+2H(g)2(NH)(g) △H2, ③(NH)(g)+H(g)![]() (NH2)(g) △H3, ④(NH2)(g)+H(g)
(NH2)(g) △H3, ④(NH2)(g)+H(g) ![]() NH3 (g) △H4,总反应为N2 (g)+3H2(g)
NH3 (g) △H4,总反应为N2 (g)+3H2(g)![]() 2NH3 (g) △H。下列说法正确的是
2NH3 (g) △H。下列说法正确的是
A. 催化剂能够有效降低反应的活化能和改变反应的焓变
B. 增大压强和使用高效催化剂均有利于提高总反应的平衡转化率
C. 反应①和总反应均为放热反应
D. △H=3△H1+△H2+2△H3+2△H4
查看答案和解析>>
科目: 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】向某密闭容器中加入0.15 mol·L-1 A、0.05 mol·L-1 C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0~t1时c(B)未画出,t1时c(B)增大到0.05 mol·L-1]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
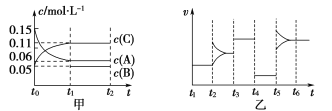
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为___mol·L-1。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:___________________________________。
(3)t3时改变的某一反应条件可能是________(填字母)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
(4)在恒温恒压下通入惰性气体,v(正)________v(逆)(填“>”“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( )
A.-488.3kJ/molB.+488.3kJ/molC.+191kJ/molD.-191kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列情况中说明2HI(g)H2(g)+I2(g)已达平衡状态的是__________
①单位时间内生成nmolH2的同时,生成nmolHI;
②1个H﹣H键断裂的同时有2个H﹣I键断裂;
③混合气中百分组成为HI%=I2%;
④反应速率v(H2)=v(I2)=![]() v(HI)时;
v(HI)时;
⑤混合气体中c(HI):c(H2):c(I2)=2:1:1时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
上述⑥~⑩的说法中能说明2NO2N2O4达到平衡状态的是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
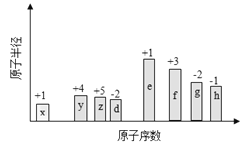
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
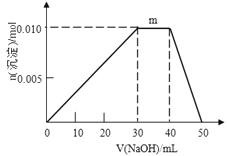
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的离子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】新冠疫情下,西方各国防护服原材料价格飞涨,以PE复合膜透气材料为代表的中国制造因物美价廉、供应充足赢得了世界赞誉。PE是由乙烯为原料合成的高分子材料的简称,乙烯的相关反应关系如下图所示:
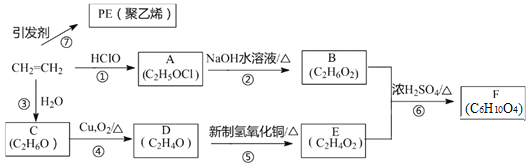
回答下列问题:
(1)C的结构简式为___________,⑦的反应类型为____________。
(2)D、E分子中含有的官能团分别为__________,_____________。
(3)写出能发生水解反应的E的同分异构体结构简式________________。
(4)写出下列反应的化学方程式:
①CH2=CH2→A__________________。
②A→B_________________。
(5)F的结构简式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是
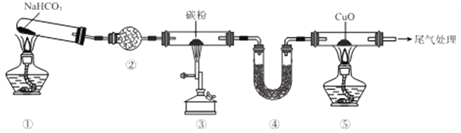
A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护。请回答下列问题:
(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染。已知:

反应过程(2)是__反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是__。
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
实验 序号 | 温度℃ | 初始n(CCl4)( mol) | 初始n(H2)( mol) | 平衡时n(CHCl3)( mol) |
1 | 110 | 0.8 | 1.2 | |
2 | 110 | 2 | 2 | 1 |
3 | 100 | 1 | 1 | 0.6 |
①此反应在110℃时平衡常数为___。
②实验l中,CCl4的转化率为__。
③判断该反应的正反应是__(填“放热”或“吸热”),理由是__。
④为提高实验3中CCl4的转化率,可采取的措施是__。
a.使用高效催化剂
b.向容器中再投入1molCCl4和1molH2
c.温度升高到200℃
d.向容器中再投入1molHCl
e.向容器中再投入1molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com