
科目: 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列化学用语中,正确的是![]()
A.![]() 的电离方程式为
的电离方程式为![]()
B.向AgCl的饱和溶液中加入足量浓![]() 溶液,溶液中各离子浓度不变
溶液,溶液中各离子浓度不变
C.常温下,![]() 的
的![]() 与氨水的混合溶液中离子浓度大小顺序:
与氨水的混合溶液中离子浓度大小顺序:![]()
D.![]() 的水解反应离子方程式:
的水解反应离子方程式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】二氟磷酸锂(LiPO2F2)作为电解液添加剂能够有效提升锂电池的循环性能。在氮气气氛下,在PFA(全氟烷氧基树脂)烧瓶中加入高纯LiPF6和Li2CO3固体,以碳酸二甲酯作溶剂制备LiPO2F2,其流程如下:
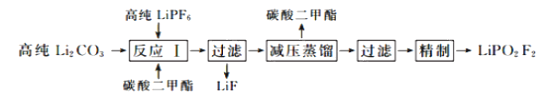
已知:LiPF6是一种白色结晶或粉末,潮解性强,遇水发生反应如下:LiPF6+H2O![]() LiF+POF3↑+2HF↑
LiF+POF3↑+2HF↑
(1)反应Ⅰ需要控制在60℃的条件下进行,适宜的加热方式为_____________。
(2)反应Ⅰ中有一种无色无味的气体生成,该气体的电子式为_______________。反应Ⅰ的化学方程式为______________________________________。
(3)高纯LiPF6需要控制适当过量的原因可能是_____________________________。 LiPO2F2制备过程中不采用玻璃仪器的原因是____________________________。
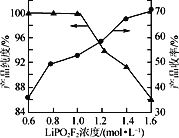
(4)保持其他实验条件都不变,在精制过程中加入提纯溶剂(杂质和LiPO2F2均可溶解在提纯溶剂中),LiPO2F2在提纯溶剂中的浓度对产品纯度和收率(收率=![]() ×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
(5)已知:常温下,碳酸锂微溶于水,碳酸氢锂可溶于水。工业级碳酸锂中含有少量难溶于水且与CO2不反应的杂质。请设计从工业级碳酸锂制备高纯碳酸锂的实验方案。(实验中须使用的试剂有:去离子水,CO2气体;除常用仪器外须使用的仪器:恒温水浴锅、真空干燥箱)__________
(6)已知碳酸锂Ksp=8.6×10-4,向浓度为0.2mol·L-1的硫酸锂溶液中加入等体积的碳酸钠溶液产生沉淀,则所加碳酸钠溶液的最低浓度为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将![]() 完全溶于水得到VmL氨水,溶液的密度为
完全溶于水得到VmL氨水,溶液的密度为![]() ,溶质的质量分数为
,溶质的质量分数为![]() ,溶质的物质的量浓度为
,溶质的物质的量浓度为![]() 下列叙述中正确的有( )
下列叙述中正确的有( )
![]() 若上述溶液中再加入水至所得溶液的质量分数等于
若上述溶液中再加入水至所得溶液的质量分数等于![]() 时,溶质的物质的量浓度小于
时,溶质的物质的量浓度小于![]() ;
;
![]() ;
;
![]() ;
;
![]() 上述溶液中再加入
上述溶液中再加入![]() 同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为
同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为![]() ;
;
A. ![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,可用作分析试剂及鞣革的还原剂,易溶于水,受热、遇酸易分解。Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。工业上常利用含硫废水生产Na2S2O3·5H2O,某化学兴趣小组在实验室中用如图所示装置(加热装置及部分夹持装置已略去)模拟其生产过程并探究其化学性质。
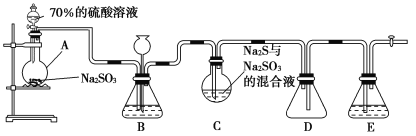
烧瓶C中发生如下反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) ①
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) ②
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) ③
Na2S2O3(aq) ③
Ⅰ.制备Na2S2O3·5H2O
(1)加入药品之前须进行的操作是_________;装置D的作用是______________;装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用________(填字母)。
A.蒸馏水 B.饱和Na2SO3溶液
C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(2)为保证硫代硫酸钠的产量,实验中产生的SO2不能过量,原因是_________;所制得的粗产品可以通过________方法进一步提纯得到纯Na2S2O3·5H2O。
Ⅱ.测定产品纯度
准确称取w g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.10 mol·L-1I2的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-。
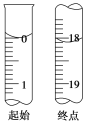
(3)滴定至终点时的现象:______________。滴定起始和终点时I2的标准溶液液面位置如图所示,则消耗I2的标准溶液的体积为________mL。产品的纯度为________(设Na2S2O3·5H2O的相对分子质量为M,列出用M、w表示的表达式)。
Ⅲ.探究Na2S2O3的部分化学性质
(4)(提出假设)
假设一:Na2S2O3与Na2SO4的结构相似,化学性质也应该相似,因此,室温时Na2S2O3溶液的pH=7。
假设二:从S的化合价推测Na2S2O3具有较强的还原性。
(验证假设) 配制适量Na2S2O3溶液,进行如下实验,请将实验补充完整。
实验操作 | 实验结论 或现象 | 现象解释(用离子 方程式表示) | |
假设一 | ________ | 溶液pH=8 | ________ |
假设二 | 向溴水中 滴入适量 Na2S2O3 溶液 | 溴水褪色 | ________ |
实验结论:________________________________________。
Ⅳ.Na2S2O3的应用
(5)Na2S2O3的商品名为“海波”,俗称“大苏打”,化学上常用于滴定实验。为测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00 mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量稀H2SO4,滴加几滴指示剂,用0.10 mol·L-1 Na2S2O3标准溶液滴定至终点,进行3次平行实验后,测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7)=________mol·L-1。(已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2S2O32-+I2=S4O62-+2I-)
Ⅴ.探究与反思
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将实验方案补充完整。
取适量产品配成稀溶液,___________________(所需试剂从BaCl2溶液、稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色.试回答以下问题:
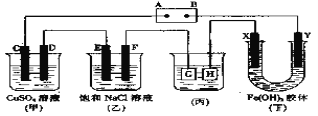
(1)电源A极的名称是_______。甲装置中电解反应的总化学方程式_____________________。
(2)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(3)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式),G电极发生的反应是_____________________________。
(4)装置丁中的现象是__________________________,说明______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向某密闭容器中充入一定量的H2和I2蒸气,发生如下反应:H2(g)+I2(g)![]() 2HI(g),反应达到平衡,下列说法正确的是
2HI(g),反应达到平衡,下列说法正确的是
A.平衡时,正逆反应速率相等且等于零
B.平衡时,c( H2)=c(I2)=c(HI)
C.平衡时只有H2和I2反应生成HI
D.平衡时,混合气体的所有成分的质量分数均保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。

已知:i. 
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________

(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)=CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数表达式K=_________________
(2)已知1100℃时K=0.263。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_______平衡常数K值___(均填增大,减小或不变).
(3)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态________(选填是或否),此时化学反应速率v正____v逆(选填>,<,=)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com