
科目: 来源: 题型:
【题目】请按要求填空做答。
(1)NaHCO3能用于治疗胃酸过多,反应的离子方程式为_______。
(2)铁和水蒸气反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,该反应中84g Fe参加反应,转移电子的物质的量为__________。
Fe3O4+4H2,该反应中84g Fe参加反应,转移电子的物质的量为__________。
(3)制备Fe(OH)3的实验操作:向煮沸的蒸馏水中加入几滴FeCl3溶液,______。
(4)密度为1.84g/cm3,质量分数为98%的浓硫酸的物质的量浓度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
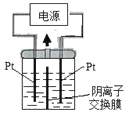
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目: 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛。 “铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为______________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
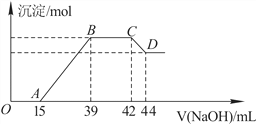
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:____________________
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为__________________。
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________;
(4)熔融物中铝元素的物质的量为________mol。
(5)B点对应的沉淀的物质的量为______mol,A点对应的氢氧化钠溶液的体积为________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z、M、R为6种短周期元素。W原子的核电荷数等于其周期数,X+与Ne具有相同的电子层结构,Y原子与Z原子的最外层电子数之和与R原子的最外层电子数相等;Y、Z、M、R在周期表中的相对位置如图所示。
Z | M | R | ||
Y |
(1)Z元素在周期表的位置为________。
(2)R离子的结构示意图为_________。
(3)X与M以1:1形成的化合物中存在的化学键类型为____________。
(4)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为_________________________________。
(5)Y与Z 形成相对分子量为144的化合物与M的简单氢化物反应,生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为__________________________。
(6)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )

A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废气H2S经资源化利用后可回收能量并得到单.质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( )

A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
D. 若电路中通过2mol电子,则电池内部释放632kJ热能
查看答案和解析>>
科目: 来源: 题型:
【题目】向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是
A.当0<b<a/3时:SO2+H2O+3ClO-=![]() +2HClO+Cl-
+2HClO+Cl-
B.当b=a时,SO2+H2O+ClO-==2H++Cl-+![]()
C.当a/3≤b≤a时,反应后溶液中H+的物质的量: 0<n(H+)≤2b mol
D.当0<b<a时,反应后溶液中ClO-、Cl-和![]() 物质的量之比为:(a-b)∶b∶b
物质的量之比为:(a-b)∶b∶b
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
完成下列表格
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③加入过量稀盐酸 | ④___________,有刺激性气体产生 |
⑤静置,(吸)取上层清液,滴入BaCl2溶液 | ⑥_______________________________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至刻线。
②滴定:用___________________取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72—+6I+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32—=S4O62—+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液_____________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(2)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 配位键 E 范德华力
(3)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ_________g·cm-3。
,该晶体的密度ρ_________g·cm-3。
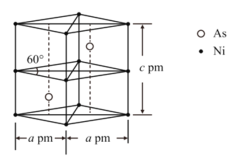 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的结构式为________
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_________。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为_____,通入b气体的电极反应式_______.(质子交换膜只允许H+通过)

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在_________左右。
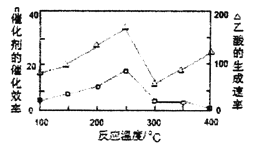
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_________
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com