
科目: 来源: 题型:
【题目】激素类药物己烯雌酚的结构简式如图所示。下列叙述正确的是
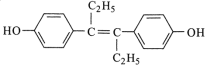
A.己烯雌酚是芳香烃
B.1mol己烯雌酚可与6molH2发生加成反应
C.1mol己烯雌酚完全燃烧能生成18molCO2和12 molH2O
D.己烯雌酚苯环上的一氯代物有两种(不包括立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
①![]() 、
、![]() 、
、![]() 属于碱性氧化物,
属于碱性氧化物,![]() 、
、![]() 、
、![]() 都能和碱溶液发生反应属于酸性氧化物
都能和碱溶液发生反应属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③混合物:漂白粉、水玻璃、![]() 胶体、冰水混合物
胶体、冰水混合物
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤硅导电,铝在浓硫酸中钝化均属于物理变化
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A.①③⑤B.④⑤⑥C.②④⑥D.②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】酮洛芬是优质抗炎镇痛药,合成原理如下:
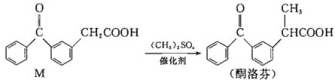
下列说法正确的是( )
A.M和酮洛芬都能发生酯化、卤代和加成反应
B.M和酮洛芬分子中所有碳原子都可能共平面
C.M和酮洛芬在一定条件下最多消耗![]() 的物质的量相等
的物质的量相等
D.M分子中苯环上一氯代物有9种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象及结论均正确的是 ( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将盛有等物质的量的氯气和甲烷的硬质大试管放在光亮处 | 试管内气体颜色变浅,试管壁出现油状液滴,试管中有少量白雾 | 甲烷和氯气发生了加成反应 |
B | 向葡萄糖溶液中滴加新制的氢氧化铜溶液,小火加热 | 有砖红色沉淀生成 | 葡萄糖中含有醛基 |
C | 向 | 产生有香味的液体,沉在饱和碳酸钠溶液底部 | 有乙酸乙酯生成 |
D | 将苯与液溴的混合物装入洁净试管中,振荡一段时间后,将混合物倒入盛有水的烧杯中 | 烧杯底部有油状液体 | 苯与液溴发生了取代反应,溴苯难溶于水,密度比水大 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)又叫乙二酸,广泛存在于植物源食品中,25℃时,其解离常数Kal=5.9×10-2; Ka2= 6.4×10-5。下列与草酸有关的说法错误的是
A.H2C2O4(aq) H+(aq) +HC2O4-(aq) △H >0;升温有利于提高草酸的电离程度
B.草酸中的碳为+3价,具有较强的还原性,可使酸性高锰酸钾溶液褪色
C.25℃时,KHC2O4溶液呈弱酸性,有时用于清洗金属表面的锈迹
D.同浓度的KHC2O4和K2C2O4混合溶液中:2c( H2C2O4) +2c( HC2O4)+2c( C2O42-) =3c(K+)
查看答案和解析>>
科目: 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。
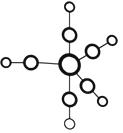
(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。
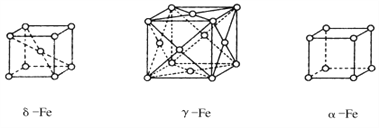
①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。实验步骤如下
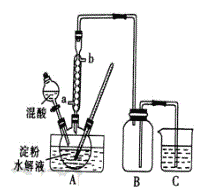
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为__________;步骤②中,水浴加热的优点为___________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:_____C6H12O6+______HNO3![]() ______H2C2O4+9NO2↑+3NO↑+_________
______H2C2O4+9NO2↑+3NO↑+_________
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a mol/LKMnO4标准液滴定,只发生5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为V mL,则所得草酸晶体(H2C2O4·2H2O)的纯度为_________。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择右侧装置验证产物CO2,装置B的主要作用是_______________。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为验证是否有CO,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
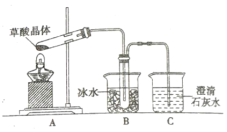




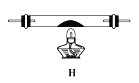
①乙同学的实验装置中,依次连接的合理顺序为A、B、_________。其中装置H反应管中盛有的物质是_____________。(写化学式)
②能证明草酸晶体分解产物中有CO的现象是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H是合成有机光电材料的原料。H的一种合成路线如图:
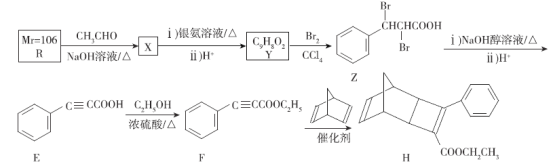
已知:R属于芳香族化合物,与新制Cu(OH)2悬浊液共热产生红色固体。请回答下列问题:
(1)R的化学名称是___________;X中官能团的名称是___________。
(2)F→H的反应类型是___________。
(3)E→F的化学方程式为______________。
(4)检验Z中溴元素的试剂有NaOH溶液、AgNO3溶液和___________。
(5)在Y的同分异构体中,同时具备下列条件的同分异构体有________种(不包含立体异构)。
①能发生银镜反应;②遇氯化铁溶液发生显色反应;③能与溴的四氯化碳溶液发生加成反应。
其中核磁共振氢谱有6组峰且峰面积比为1:1:1:1:2:2的结构简式为_________。
(6)参照上述流程,请设计以一溴环已烷和2-丁炔为起始原料制备![]() 的合成路线:__________(无机试剂任选)。
的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)= CH3OH(l)△H=-37.3 kJ/mol,则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H=_______kJ/mol。
CH3OH(g)+H2O(l)△H=_______kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0 L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 M Pa和5.0 MPa下CO2转化率随温度的变化关系。
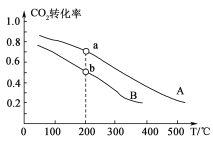
①其中a点的平衡常数表达式为:_________________。
②a,b两点化学反应速率分别用va、vb表示,则va________vb (填“大于”、“小于”或“等于”)。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
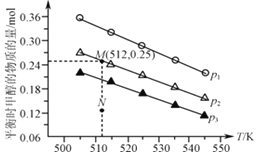
A. 该反应的正反应为放热反应
B. 压强大小关系为p1<p2<p3
C. M点对应的平衡常数K的值约为1.04×10-2
D. 在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用![]() 生产甲醇
生产甲醇
(4)已知:CO(g)+2H2(g)![]() CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
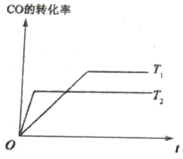
①该反应的焓变△H ______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_________K2(填“>”“<”或“=”)。
Ⅲ.甲醇的应用
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为___________。
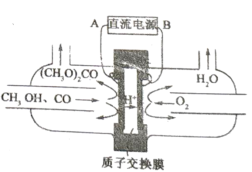
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com