
科目: 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题。
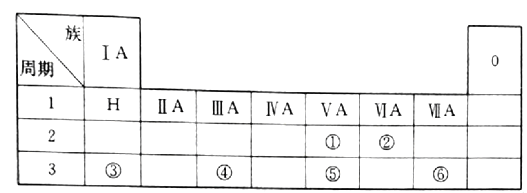
(1)② 表示的元素是______(填元素符号);
(2)①、⑤两种元素的原子半径大小为②______⑤(填“< ”或“>”);
(3)⑤所在元素周期表中的位置是_____________;
(4)写出③与⑥两种元素所形成化合物的化学式_________;
(5)④所表示元素的单质与③所表示元素的最高价氧化物的水化物在溶液中反应的离子方程式为:________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
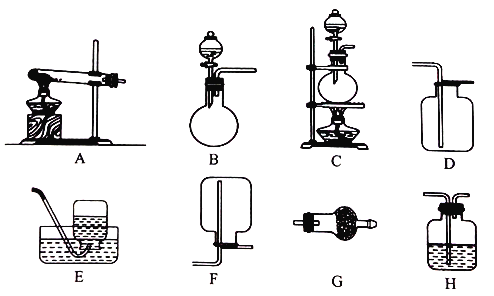
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |
查看答案和解析>>
科目: 来源: 题型:
【题目】某电池的简易装置图如下所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( )

A. a电极反应式为C2H5OH+12OH――12e-=2CO2↑+9H2O
B. AlCl3溶液中的总反应为2Cl-+2H2O=Cl2↑+H2↑+2OH-
C. 反应开始后,观察到x电极附近出现白色沉淀
D. 左侧电池每通入32gO2,右侧电解池共生成2mol气体
查看答案和解析>>
科目: 来源: 题型:
【题目】电渗析法是海水淡化的常用方法,某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法错误的是( )
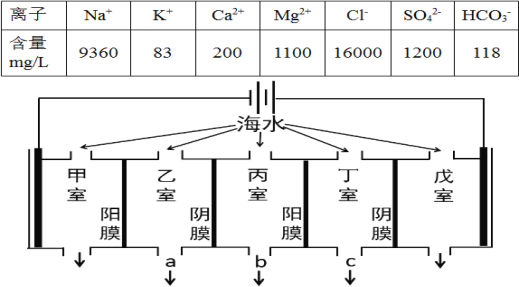
A.淡化过程中易在甲室形成水垢
B.淡化过程中戊室的电极反应式为:2Cl--2e-=Cl2↑
C.淡化过程中乙室和丁室中部分离子的浓度减小,淡水的出口为a、c
D.当甲室收集到标准状况下11.2L气体时,通过甲室阳膜的离子的物质的量一定为1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法表达错误的是
A.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响
B.“NO2球”浸入冷水中颜色变浅:2NO2(g)(红棕色)![]() N2O4(g)(无色)ΔH<0
N2O4(g)(无色)ΔH<0
C.在酸碱中和滴定实验中,装标准液的滴定管若不润洗,则实验结果偏高
D.甲烷的燃烧热为ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)==CO2(g)+2H2O(g)ΔH=-890.3kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的化学方程式或离子方程式正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.实验室用液溴和苯在催化剂作用下制溴苯:![]() + Br2
+ Br2![]()
![]() +HBr
+HBr
C.实验室用乙醇制乙烯:CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
D.少量苯酚与浓溴水的反应:![]() +3Br2
+3Br2![]()
 ↓+3HBr
↓+3HBr
查看答案和解析>>
科目: 来源: 题型:
【题目】为解决能源危机,有人提出用CaCO3制取C2H2作燃料。具体反应为:
① CaCO3(s)![]() CaO(s)+CO2(g)
CaO(s)+CO2(g)
② CaO(s)+3C(s)![]() CaC2(s)+CO(g)
CaC2(s)+CO(g)
③ CaC2(s)+H2O(l)![]() CaO(s)+C2H2(g)
CaO(s)+C2H2(g)
(1)制备1mol C2H2(g)需一定量的C(s),这些炭完全燃烧可放热__________kJ
(2)若1mol C2H2完全燃烧可放出热量1298kJ,则将C2H2(g)作为燃料是否合算?说明理由__________。
(3)为什么反应①和②需要高温,反应③只需常温__________(已知有关物质的△Hf(298k)/kJ·mol-1为:CaC2(s):—60,CO2(g):—393,H2O(l):—285,C2H2(g):227,CaO(s):—635,CaCO3(s):—1207,CO(g):—111)
查看答案和解析>>
科目: 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物pCP,探究有关因素对该降解反应速率的影响。
[实验设计]控制pCP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | ____ | ____ | ____ | ____ |
③ | ____ | 298 | 10 | 6.0 | 0.30 |
[数据处理]实验测得pCP的浓度随时间变化的关系如图:
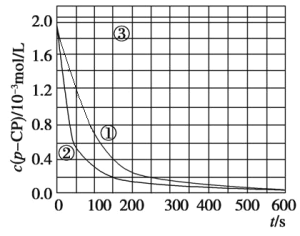
(2)请根据图中实验①曲线,列式并计算降解反应在50~150 s内的反应速率:________。
[解释与结论]
(3)实验①②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:____________。
(4)实验③得出的结论是:pH等于10时,_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
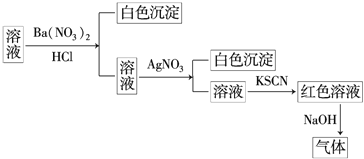
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】轻质氧化镁和硼酸(H3BO3)都是重要的化工原料,可采用硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如图:
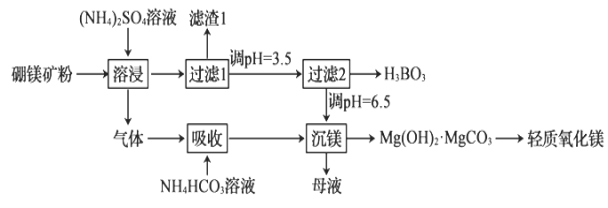
下列叙述错误的是( )
A.Fe2O3、Al2O3都不能溶于(NH4)2SO4溶液
B.进入“吸收”工序中的气体为NH3
C.若“过滤2”时调节溶液的碱性越强得到的硼酸越多
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com