
科目: 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为__________,在CB3分子中C元素原子的原子轨道发生的是__________杂化。
(2)C的氢化物的空间构型为__________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________。
(3)B元素的电负性__________D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:__________。
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为__________。(阿伏加德罗常数用NA表示)
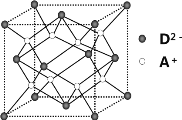
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O
请根据要求填写下列空白:
(1)溶液①呈_________性(填“酸”、“碱”或“中”),其原因是_____________(用离子方程式表示)。
(2)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是____(填序号)。
(3)在溶液④中,_____________离子的浓度为0.1mol/L;NH3H2O和________离子的物质的量浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____________c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向10 mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,溶液中-lgc(Cu2+)与滴加的Na2S溶液体积(V)的关系如图所示(忽略体积变化)。下列判断正确的是
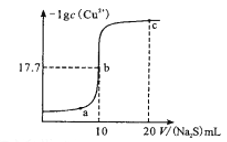
A. a、b、c三点中,b点水的电离程度最大
B. a点:2c(Cu2+)+c(H+)=c(Cl-)+c(OH-)
C. c点溶液:c(Cu2+)=3×10-34.4mol/L
D. c点溶液有:n(S2-)+n(HS-)+n(H2S)=n(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列判断正确的是
A.Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2O32-+4H+![]() SO42-+ 3S↓+ 2H2O
SO42-+ 3S↓+ 2H2O
B.用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
C.滴加甲基橙试液后呈红色的溶液中可以大量共存: Na+、 CO32-、 K+、 AlO2-
D.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
查看答案和解析>>
科目: 来源: 题型:
【题目】脑白金的主要成分的结构简式如图:
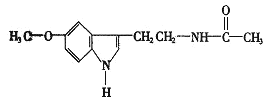
下列对脑白金主要成分的推论错误的是( )
A.其分子式为C13H16N2O2
B.能水解生成乙酸
C.能与溴水发生加成反应
D.其营养成分及官能团与葡萄糖相同
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温下浓度均为![]() 的下列5种溶液:
的下列5种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是________________,其中由水电离的
这5种溶液pH由大到小的顺序是________________,其中由水电离的![]() 浓度最小的是______。
浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是________________________________________________________,
中各离子浓度由大到小的顺序是________________________________________________________,![]() 的水解平衡常数
的水解平衡常数![]() _________________。
_________________。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时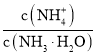 的值__________
的值__________![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是____________
的溶液分别蒸干并灼烧,最终可得原溶质的是____________![]() 填序号
填序号![]() 。
。
![]() 一定量的稀
一定量的稀![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
![]() 常温下,向
常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为_____
的溶液为_____![]()
![]() 已知常温下
已知常温下![]() 。
。
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈__________________性,溶液中
的醋酸等体积混合后溶液呈__________________性,溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 常温下,用
常温下,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图.
某一元酸HA溶液所得滴定曲线如图.
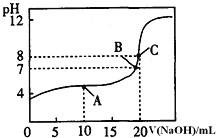
![]() A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() 点的离子浓度大小关系是 ________________________________ .
点的离子浓度大小关系是 ________________________________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是不同温度下水的离子积数据:
温度 | 25 |
|
|
水的离子积常数 |
|
|
|
试回答以下问题:
![]() 若
若![]() ,则
,则![]() __________
__________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,作出此判断的理由是__________。
,作出此判断的理由是__________。
![]() 下,某
下,某![]() 溶液中
溶液中![]() ,取该溶液
,取该溶液![]() ,加水稀释至
,加水稀释至![]() ,则稀释后溶液中
,则稀释后溶液中![]() span>__________。
span>__________。
![]() 下,将
下,将![]() 的苛性钠溶液
的苛性钠溶液![]() 与
与![]() 的稀硫酸
的稀硫酸![]() 混合
混合![]() 设混合后溶液的体积为原两溶液体积之和
设混合后溶液的体积为原两溶液体积之和![]() ,所得混合溶液的
,所得混合溶液的![]() ,则
,则![]() __________。此溶液中各种离子的浓度由大到小的排列顺序是__________________。
__________。此溶液中各种离子的浓度由大到小的排列顺序是__________________。
![]() 分别向等体积、相同pH的HCl溶液和
分别向等体积、相同pH的HCl溶液和![]() 溶液中加入足量的Zn粉,反应刚开始时产生
溶液中加入足量的Zn粉,反应刚开始时产生![]() 的速率:
的速率:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”下同
”下同![]() ,反应完全后,所得氢气的质量:
,反应完全后,所得氢气的质量:![]() 盐酸_______
盐酸_______![]() 醋酸。
醋酸。
查看答案和解析>>
科目: 来源: 题型:
【题目】在![]() 时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知
时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知![]() 时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
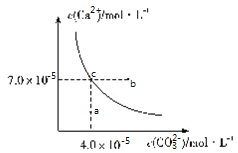
A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B.图中b点碳酸钙的结晶速率小于其溶解速率
C.通过蒸发,可使溶液由a点变化到c点
D.在25℃时,反应![]() 的平衡常数K=3500
的平衡常数K=3500
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com