
科目: 来源: 题型:
【题目】铁、铜及其化合物在工农业生产中应用广泛。
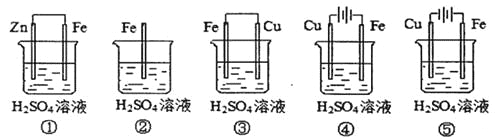
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为_______。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是____________(用序号填写)。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)![]() H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)![]() H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为______________。
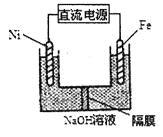
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式______。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是______________。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是____________。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为____。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=______。
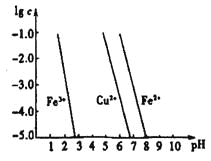
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度![]() 10-5mol·L-1时,可认为沉淀完全)。
10-5mol·L-1时,可认为沉淀完全)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、制取氨气并完成喷泉实验(图中夹持装置均已略去)。
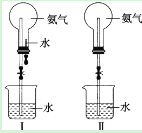
(1)写出实验室制取氨气的化学方程式______。
(2)收集氨气应使用______法,要得到干燥的氨气可选用作干燥剂______。
(3)如果只提供如图Ⅱ所示装置,请说明引发喷泉的方法是______。
Ⅱ.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
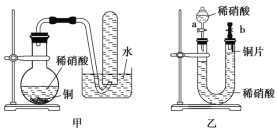
(1)写出铜和稀硝酸反应的离子方程式:______。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是 NO 气体______(填“能”或“不能”),请简述理由(用文字和化学方程式表示):______。
(3)若用实验装置乙进行实验,检查装置气密性的操作是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】若将 SO2 通入硝酸钡溶液中,有白色沉淀产生,其化学反应方程式如下(未配平): SO2+ Ba(NO3)2+ H2O —— BaSO4↓+ HNO3+ NO↑
(1)配平上述化学反应方程式并用双线桥表示电子转移的方向和数目________。
(2)该反应中,_______发生氧化反应,氧化剂是_______。氧化产物与还原产物的物质的量之比为 _______。
(3)当反应消耗二氧化硫 19.2 g 时,反应中转移电子数目为_______ ,生成 NO 的体积为 _______(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
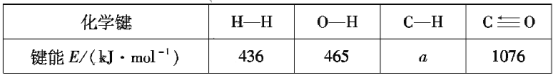
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。

某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
已知反应:![]()
![]()
![]()
![]() 工业制取炭黑的方法之一是将甲烷隔绝空气加热到
工业制取炭黑的方法之一是将甲烷隔绝空气加热到![]() 进行裂解。该反应的热化学方程式为______。
进行裂解。该反应的热化学方程式为______。
![]() 容积固定为1L的密闭容器内充入
容积固定为1L的密闭容器内充入![]() 和
和![]() ,保持
,保持![]() 发生反应
发生反应![]() ,用压力计监测反应过程中容器内压强的变化如下表:
,用压力计监测反应过程中容器内压强的变化如下表:
反应时间 | 0 | 5 | 10 | 15 | 20 | 25 |
压强 |
|
|
|
|
|
|
则反应从开始到20min时,以CO浓度变化表示的平均反应速率![]() ______。
______。
![]() 对于反应
对于反应![]() 来说:
来说:
![]() 时,平衡常数
时,平衡常数![]() 。
。![]() 测得密闭容器中各物质达到平衡时物质的量浓度分别为:
测得密闭容器中各物质达到平衡时物质的量浓度分别为:![]() ,
,![]() ,
,![]() ,
,![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 下列措施有利于提高反应混合气中
下列措施有利于提高反应混合气中![]() 含量的是______。
含量的是______。
A.使用催化剂 ![]() 升高温度
升高温度 ![]() 及时导出CO
及时导出CO![]() 增大反应体系的压强
增大反应体系的压强
![]() 一定条件下,将
一定条件下,将![]() 与
与![]() 按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
A.![]()
![]()
B.体系中混合气体密度不变
C.![]() 与
与![]() 的转化率相等
的转化率相等
D.![]() 与
与![]() 物质的量之比不再改变
物质的量之比不再改变
E.反应体系压强不再改变
![]() 以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
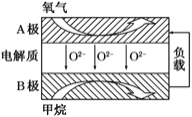
![]() 极上的电极反应式为______。
极上的电极反应式为______。
![]() 以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到
以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到![]() 标准状况
标准状况![]() 气体时,消耗甲烷的体积为______
气体时,消耗甲烷的体积为______![]() 标准状况
标准状况![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下反应均可生成![]() 。下列有关说法正确的是
。下列有关说法正确的是![]()
![]() 二氧化碳分解生成氧气:
二氧化碳分解生成氧气:![]() ;
;![]()
![]() 过氧化氢分解生成氧气:
过氧化氢分解生成氧气:![]() ;
;![]()
![]() 光照条件下,催化分解水蒸气生成氧气:
光照条件下,催化分解水蒸气生成氧气:![]() ;
;![]() 。
。
A.反应![]() 使用催化剂,能降低该反应的活化能
使用催化剂,能降低该反应的活化能
B.反应![]() 为吸热反应
为吸热反应
C.反应![]() 将化学能转化为光能
将化学能转化为光能
D.反应![]() ;
;![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH-,下列叙述正确的是 ( )
A.将水加热,![]() 增大,pH不变
增大,pH不变
B.向水中加入少量盐酸,![]() 增大,
增大,![]() 不变
不变
C.向水中加入NaOH固体,平衡逆向移动,![]() 降低
降低
D.向水中加入FeCl3固体,平衡正向移动,![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】BrF3是应用最广泛的一种卤素互化物,还是一种很好的溶剂,它能与H2O反应生成Br2、HBrO3、O2和HF。下列说法正确的是( )
A.该反应中,有三种元素化合价发生改变
B.该反应的还原剂为BrF3,氧化产物为O2
C.生成0.1molO2,有0.4mole-转移
D.0.9molBrF3参加反应,被H2O还原的BrF3为0.4mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | |||||||
(1)表中元素__
(2)表中元素⑦的原子结构示意图为__,在周期表中的位置为____
(3)表中元素⑥⑩的氢化物的稳定性顺序为__(填写化学式,下同)。
(4)表中元素⑩的最高价氧化物对应水化物的酸性:__。
(5)表中元素②和⑦的最高价氧化物对应水化物的碱性:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如图,下列有关叙述中不正确的是![]()
![]()
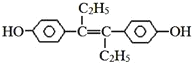
A.该有机物在一定条件下能发生加聚反应和氧化反应
B.该有机物可与NaOH和Na2CO3发生反应
C.1mol该有机物可以与5molBr2发生反应
D.该有机物分子中,最多有16个碳原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com