
科目: 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是( )
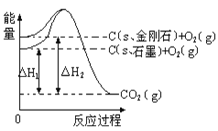
A. C(s、石墨)==C(s、金刚石)△H=+1.9kJmol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C 为短周期元素,它们的位置关系如图所示,已知 B、C 两元素原子核内质子数之和是 A 元素的原子核内质子数的 4 倍。

(1)写出 A、B 的元素符号:A____、B____。
(2)B 在周期表中的位置为____,C 的离子结构示意图为____。
(3)A 的氢化物的分子式为____;B、C 的最高价氧化物对应的水化物的分子式分别为____、____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 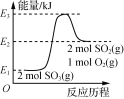 由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
B. 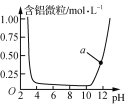 表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
C. 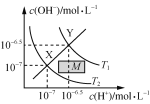 温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
D. 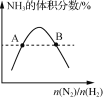 表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车内燃机燃烧时,在高温引发氮气和氧气反应会产生 NOx 气体,NOx 的消除是科研人员研究的重要课题。
(1)通过资料查得 N2(g)+O2(g)2NO(g)△H反应温度不平衡常数的关系如下表:
反应温度/℃ | 1538 | 2404 |
平衡常数 |
|
|
则△H___________________0(填“<”“>”戒“=”)
(2)在 800℃时,测得 2NO(g)+O2(g) 2NO2(g)的反应速率不反应物浓度的关系如下表所示
初始浓度/ | 初始速率/ | |
C0(NO) | C0(O2) | |
0.01 | 0.01 |
|
0.01 | 0.02 |
|
0.03 | 0.02 |
|
已知反应速率公式为 V 正=K 正×c m(NO)cn(O2),则 m=___________________, K 正=___________________L2mol-2s-1
(3)在某温度下(恒温),向体积可变的容器中充人 NO2 气体,发生反应 2NO2(g) N2O4(g),气体分压随时间的变化关系如图
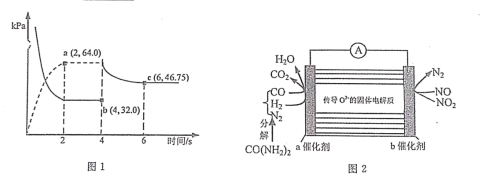
①该反应的压力平衡常数 KP=___________________。
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=___________________kPa。
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2 在 b 电极上的电极反应式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
已知:反应1 CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
反应2 2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
则该催化重整反应的△H=___kJmol-1。
(2)有科学家提出可利用FeO吸收CO2:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s),对该反应的描述正确的是__。
2Fe3O4(s)+C(s),对该反应的描述正确的是__。
A.增大FeO的投入量,利于平衡正向移动
B.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
D.恒温恒压下,气体摩尔质量不变可作为平衡的标志
E.若该反应的△H﹤0,则达到化学平衡后升高温度,CO2的物质的量会增加
(3)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
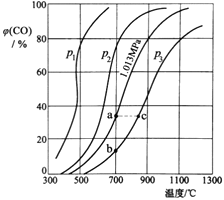
①图中p1、p2、p3的大小关系是______,图中a、b、c三点对应的平衡常数Ka、Kb、Kc的大小关系是______。
②900℃、1.013MPa时,1molCO2与足量碳反应达平衡后容器的体积为VL,CO2的转化率为___(保留一位小数),该反应的平衡常数K=___。
③将②中平衡体系温度降至640℃,压强降至0.1013MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
(4)在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO3-):c(CO32-)=4:1,此时溶液pH=______。(已知:室温下,H2CO3的k1=4×10-7,k2=5×10-11。lg2=0.3)
查看答案和解析>>
科目: 来源: 题型:
【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。
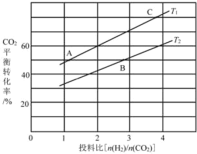
(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%
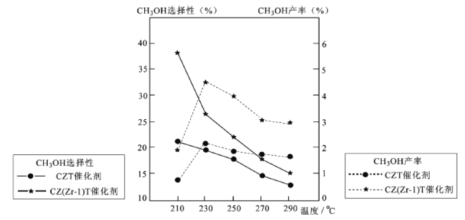
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目: 来源: 题型:
【题目】已知碳碳单键可以绕键轴旋转,某烃结构简式可表示为CH3![]()
![]() ,下列说法中正确的是( )
,下列说法中正确的是( )
A.分子中最多有22个原子处于同一平面上
B.该烃苯环上的一氯代物只有一种
C.分子中至少有10个碳原子处于同一平面上
D.该烃是苯的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是
A.NaOH溶液B.CH3COOHC.稀HNO3D.CH3CH2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com