
科目: 来源: 题型:
【题目】以甲醇和石油裂解气为原料可制得E,已知E由两种均具有芳香气味的有机物组成的混合物。相关物质转化关系如下:
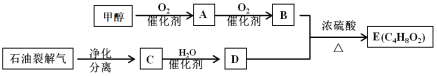
请回答:
(1)写出C中官能团的化学式_______________。A的结构简式是___________________。
(2)C→D的化学方程式是_______________________________ 、_____________________________。
(3)含有相同官能团的有机物通常具有相似的化学性质,因此可以预测E具有与___________类化合物相似的化学性质。除去化合物B、D和E混合物中的B、D,可采用的方法是:__________________________________________________________________________。
(4)写出一种以![]() 为原料制备
为原料制备 ![]() 的合成路线。(各物质用结构简式表示即可,合成路线常用的表示方式为:__________________________________________________________
的合成路线。(各物质用结构简式表示即可,合成路线常用的表示方式为:__________________________________________________________![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:

(1)写出通入CO2和NH3的化学反应方程式_________________________________________________。在 饱和食盐水中通入CO2和NH3,先通NH3后通CO2的原因是_____________________________。
(2)母液中除H+和OH-外,还含有的离子是_____________。 向母液中通氨气,加入细小食盐颗粒,冷却 析出副产品,通氨气的作用有____________。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(3)上述流程中X物质的分子式_______。使原料氯化钠的利用率从70%提高到90%以上,主要是 设计了_______(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____。
(4)写出检验产品碳酸钠中是否含有氯化钠的简要方案:___________________________________________________________________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
称取样品ag,加水溶解,加入足量的BaCl2溶液,经过滤、洗涤、干燥,最终得到固体bg。样品中纯 碱的质量分数为___________________(用含a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
写出白磷(P4)由Ca3(PO4)2焦炭和SiO2在一定条件下反应的热化学方程式为: _____________。
(2)电子工业中清洗硅片上的SiO2(s)的反应为SiO2(s)+4HF(g)===SiF4(g)+2H2O(g) ΔH(298.15 K)=-94.0 kJ·mol-1 ΔS(298.15 K)=-75.8 J·mol-1·K-1,设ΔH和ΔS不随温度而变化,此反应自发进行的温度是_________
Ⅱ.(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨相比较, __________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=___。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 __________。
(2)已知:N2O2分子中化学键的键能分别是946 kJ/mol497 kJ/mol。N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ/mol。NO分子中化学键的键能为 _____________kJ/mol。
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:__________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
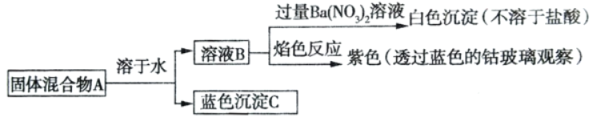
A.固体混合物 A 是 CuSO4 和 NaOH
B.固体混合物 A 是 CuSO4 和 KOH
C.固体混合物 A 是 CuCl2 和 KOH
D.固体混合物 A 是 CuSO4 和 Ba(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
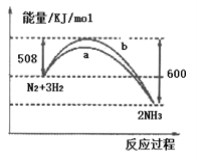
A.在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为92kJ
B.a曲线是加入催化剂时的能量变化曲线,催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
C.催化剂,能增大有效碰撞次数,但不能提高N2的转化率
D.该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)有像食盐一样的咸味,被称为工业盐。已知:亚硝酸是弱酸,且NO+NO2 +2NaOH=2NaNO2+H2O。某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用下图所示仪器(夹持装置已省略)及药品,验证自己的假设。已知沸点:NO2为21℃,NO为-151℃

(1)上述仪器的连接顺序为:A→____→_____→_____→B。
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是____________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体,
① 依据___________________现象,可确认产物中有NO
② 装置E的作用是_________________。
(4)如果没有装置C,对实验结论的影响是____________________。
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为_______________。
(6)己知:2NaNO2+4HI=2NaI+I2+2NO+2H2O,根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E. 食醋 F.白酒
查看答案和解析>>
科目: 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。
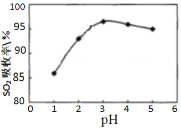
(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
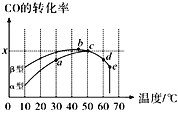
(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
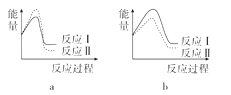
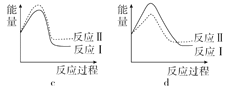
(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
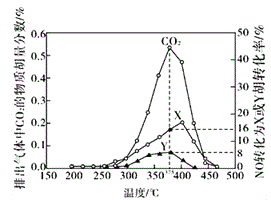
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A. 同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B. BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C. BaSO4和BaCO3共存的悬浊液中, 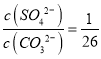
D. BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com