
科目: 来源: 题型:
【题目】X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如下图转化关系,回答下列问题:
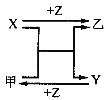
(1)若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子,Y原子的电子排布图为_________,乙的电子式为________;
(2)若X为非金属,甲是由两种短周期元素的原子构成的A2B型极性分子,且是常见的溶剂,甲的电子式___,乙的化学式为_____;
(3)若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与科技、生产、生活密切相关。下列有关说法不正确的是
A.利用高纯单质硅的半导体性能,可以制成光电池,将光能直接转化为电能
B.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
C.我国首艘国产001A型航母用于舰载机降落的拦阻索是特种钢缆,属于金属材料
D.纳米铁粉可以高效去除污染水体中的![]() 、
、![]() 、
、![]() 、
、![]() 等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附
等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 乙酸乙酯与稀硫酸共热、搅拌 | 液体不再分层 | 乙酸乙酯在酸性条件下完全水解成可溶性物质 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 生成白色沉淀 | 蛋白质发生了变性 |
C | 淀粉在稀硫酸的作用下水解后,加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】党的十九大,继续倡导可持续发展理念,建设健康和谐美丽中国。下列错误的是
A.利用垃圾焚烧产生的热能发电或供热,从而充分地利用生活垃圾中的生物质能
B.通过煤的液化、气化等物理方法可以将煤转化为CO、![]() 等燃料,提高煤燃烧的热效率
等燃料,提高煤燃烧的热效率
C.推出共享单车,呼吁全民绿色出行,从而减少汽车尾气的排放
D.推广使用天然气和液化石油气等清洁燃料,从而减少大气污染物的排放
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
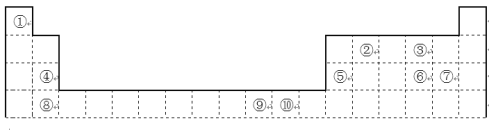
请回答下列问题:
(1)表中属于ds区的元素是(填编号)____________。
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法正确的是______。
A.分子中含极性共价键 B.含有1个σ键和2个π键 C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
I.金属性最强的主族元素是_______(填元素名称);
II.⑤、⑥、⑦的离子半径由小到大的顺序是_____(填化学式);
III.⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是____(填化学式)。
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_;该元素与元素①形成的分子X的空间构型为_。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A.为了提高能源的利用率,各国都加大了能源开采力度
B.冰箱冷冻室中的食品可以长期保存而不变质
C.水晶是熔融态二氧化硅缓慢冷却形成的,而玛瑙则是热液快速冷却而形成的,主要成分都是![]()
D.将废旧塑料回收后可以加工成燃料,以补充能源和防止白色污染
查看答案和解析>>
科目: 来源: 题型:
【题目】在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
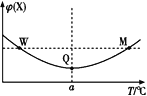
A.M点时,Y的转化率最大B.升高温度,平衡常数减小
C.W点时 v正 = v逆D.W、M两点Y的正反应速率相同
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)决定化学反应速率的主要因素是参加反应的物质的________,影响化学反应速率的外因有_______________________(至少填2个);
(2)H2C2O4与KMnO4反应时,它转化为CO2和H2O。实验现象________________
(3)氢氧化钡晶体Ba(OH)2·8H2O与氯化铵反应方程式_________________。
(4)Na2S2O3与稀H2SO4反应离子方程式_______________________。
(5)将向含有KI和H2SO4的混合溶液中加入淀粉溶液,放置一段时间实验现象。________
(6)在H2O2溶液中加入少量MnO2实验现象____________
(7)当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则热化学方程式_______________
(8)由金红石(TiO2)制取单质Ti,涉及的步骤为:TiO2→TiCl4+Mg→Ti。已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=__________
查看答案和解析>>
科目: 来源: 题型:
【题目】加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
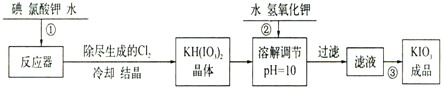
(1)已知步骤①反应器发生的反应为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,该反应的还原产物为___;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是___。
温度/℃ | 20 | 40 | 60 | 80 |
KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
(3)①已知:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32-=2I-+S4O62-,
测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是___mol·kg-1(以含w的代数式表示)。
②学生乙又进行了下列实验:
操作步骤 | 实验现象 |
取1g纯净的NaCl,加3mL水配制溶液 | 溶液无变化 |
滴入5滴淀粉溶液和1mL0.1mol·L-1KI溶液,振荡 | 溶液无变化 |
然后再滴入1滴1mol·L-1的H2SO4,从发振荡 | 溶液变蓝色 |
请推测实验中产生蓝色现象的可能原因,用离子方程式表示___。
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:___。
(4)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①根据上述实验现象,加碘盐中可能含有的物质中不能确定的是___。
②第二份试液中加入足量KI固体后,反应的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述错误的是
A. BaCO3是难溶于水的强电解质,在医学上用作钡餐
B. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C. 施肥时,草木灰不能与铵态氮肥混合使用,否则会降低肥效
D. 锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com