
科目: 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关有机物的说法正确的是( )
A.苯、甲苯互为同系物,都能使酸性高锰酸钾褪色
B.二氯丁烷的同分异构体为8种(不考虑立体异构)
C.乙烯中含有碳碳双键,苯中不含有碳碳双键,但两者均可以发生加成反应
D.饱和硫酸铜和饱和硫酸铵都能使蛋白质溶液产生沉淀,其原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子价电子排布式为_________。
(2)ZnF2具有较高的熔点(872℃),ZnF2不溶于有机溶剂,而ZnI2能够溶于乙醇、乙醚等有机溶剂,ZnI2晶体类型是__________。
(3)S和O为同主族元素,但两者的简单氢化物的熔沸点差异较大,其原因为:____。
(4)化合物Cl2O的立体构型为________,O原子的杂化方式为_____,可由Cl2与湿润的Na2CO3反应可制备,其化学方程式为_______。
(5)Na和O能够形成某种化合物,其晶胞结构与CaF2相似,如图所示,晶胞参数边长a cm,晶胞中O原子的配位数为_______;列式计算该晶体的密度(g·cm-3)_____。
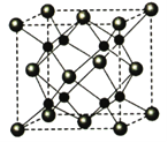
查看答案和解析>>
科目: 来源: 题型:
【题目】计算机记忆材料生产中产生大量的钌废料,一种从钌废料[含Ru(OH)3、FeO、MnO、SiO2及少量的Au]中合成六氯钌酸铵[(NH4)2RuCl6]的流程如下:
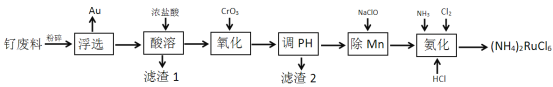
回答下列问题
(1)(NH4)2RuCl6中Ru的化合价为___________。
(2)滤渣1的成分是________ 。
(3)加入CrO3发生反应的离子方程式为______________ 。
(4)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,调pH时,应调整的pH范围为_________。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Cr3+ | 4.6 | 5.9 |
Fe2+ | 5.8 | 11.2 |
Mn2+ | 8.8 | 10.9 |
Ru3+ | 7.9 | 11.3 |
(5)加入NaClO后,Mn以MnO2的形式沉淀而除去,该反应中氧化剂与还原剂的物质的量之比为________。
(6)氨化时发生反应的化学方程式为____________
(7)氨化时,投料比![]() 对(NH4)2RuCl6产率的影响如图所示:
对(NH4)2RuCl6产率的影响如图所示:
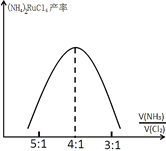
(NH4)2RuCl6的产率在![]() 为4:1后降低,其原因可能是_______________。
为4:1后降低,其原因可能是_______________。
(8)已知钌废料中钌含量为53%,氨化时产率为91%,其余步骤损失率合计为11%,则2吨钌废料可制得(NH4)2RuCl6________Kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述正确的是
![]() 浓硝酸通常保存在棕色试剂瓶中
浓硝酸通常保存在棕色试剂瓶中
![]() 检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
![]() 锌与稀硝酸反应可以得到氢气
锌与稀硝酸反应可以得到氢气
![]() 足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
![]() 浓硫酸滴到纸张上变黑,说明浓硫酸具有脱水性
浓硫酸滴到纸张上变黑,说明浓硫酸具有脱水性
![]() 浓硫酸使胆矾变白,说明浓硫酸具有脱水性
浓硫酸使胆矾变白,说明浓硫酸具有脱水性
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态?________,若未达到,哪个方向进行?__________
(2)达平衡状态时, SO2的转化率应为________?
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应aA(g)+bB(g)![]() cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图Ⅰ所示,反应速率(v)与压强(p)的关系如图Ⅱ所示。据图分析,以下说法正确的是
cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图Ⅰ所示,反应速率(v)与压强(p)的关系如图Ⅱ所示。据图分析,以下说法正确的是
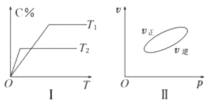
A.T1<T2,Q>0
B.增大压强,B的转化率减小
C.当反应达到平衡时,混合气体的密度不再变化
D.a+b>c+d
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,![]() 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是 ![]()
![]()
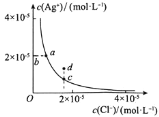
A.a点加入少量氯化钠固体,平衡逆向移动,Ag+、Cl-浓度均减小
B.加入少量水,平衡右移,Cl-浓度减小
C.d点有AgCl沉淀生成
D.d点加水稀释可以到c点
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
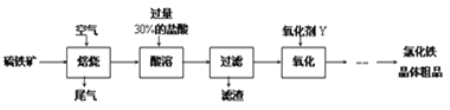
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
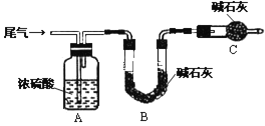
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
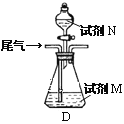
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com