
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.01 mol·L-1氯水中,Cl2、Cl-和ClO-三粒子数目之和大于0.01NA
B.在标准状况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
C.0.1 mol Cu与含0.2mol H2SO4的浓硫酸完全反应后,溶液中Cu2+数目为0.1NA
D.2.0 g D2O中含有的质子数、电子数均为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用已知物质的量浓度的NaOH测定未知物质的量浓度的盐酸,将20.00 ![]() 待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
实验编号 |
| 滴定完成时, | 待测盐酸的体积/ |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
① 滴定达到终点的标志是____________________________。
② 根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
③ 排除碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A. 滴定终点读数时俯视
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 称量的![]() 固体中混有
固体中混有![]() 固体
固体
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示实验合理的是
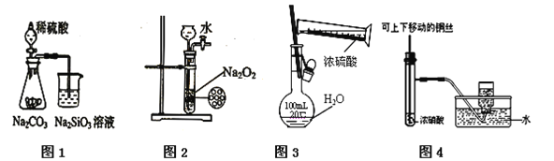
A. 图1为证明非金属性强弱:S > C > Si
B. 图2为制备少量氧气
C. 图3为配制一定物质的量浓度的硫酸溶液
D. 图4为制备并收集少量NO2气体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
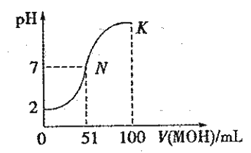
(1)由图中信息可知HA为 酸(填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH = a,则a______________7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: _____________________,此时,溶液中由水电离出的c(OH-)=_________
(3)请写出K点所对应的溶液中离子浓度的大小关系______________________。
(4)K点对应的溶液中,溶液的 pH = 10,则 c(MOH) +c(OH-) =_________________mol· L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】将![]() 镁铝合金加入到
镁铝合金加入到![]() 稀硝酸中,恰好完全反应后,收集到还原产物NO气体
稀硝酸中,恰好完全反应后,收集到还原产物NO气体![]() 标准状况,假设反应中还原产物只有
标准状况,假设反应中还原产物只有![]() ,向所得溶液中加入
,向所得溶液中加入![]() 溶液
溶液![]() ,沉淀部分溶解,下列有关叙述错误的是
,沉淀部分溶解,下列有关叙述错误的是
A.合金中Al的质量分数约为![]()
B.原稀硝酸的浓度为![]()
C.反应最终产生沉淀![]()
D.向产生沉淀后的混合液中滴加![]() 稀硝酸,产生的沉淀完全溶解
稀硝酸,产生的沉淀完全溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机化合物M,已知该有机物的蒸气对氢气的相对密度为68,核磁共振氢谱和红外光谱如图:
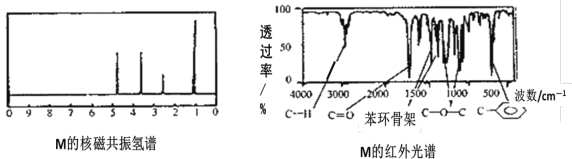
以下关于M的判断正确的是( )
A.M分子中含有两种官能团
B.M的分子式与其实验式相同
C.M一定条件下能与H2、H2O、新制氢氧化铜悬浊液等反应
D.与M属于同类有机物的同分异构体共有6种(包括M)
查看答案和解析>>
科目: 来源: 题型:
【题目】可以将氧化还原反应2H2+O2![]() 2H2O设计成原电池。
2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,电极反应式为:正极_________,负极______________。
(2)如果把KOH改为稀硫酸作电解质,则电极反应式为:正极:____________。
(3)(1)和(2)的电解质溶液不同,反应进行后,其溶液的pH各有何变化?__________。
(4)如把H2改为甲烷,KOH溶液作电解质溶液,则电极反应式为:正极:__________,负极:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为____
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) △H1=-890.3kJ/mol
C2H2(g)+2.50(g)===2CO2(g)+H2O(1) △H2=-1299.6J/mol
2H2(g)+O2(g)=2H2O(1) △H3=-571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的△H=_____kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
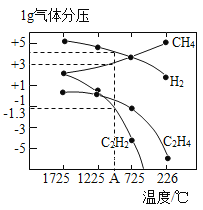
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向![]() 和
和![]() 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸![]() ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下![]() 和
和![]() 的混合气体及
的混合气体及![]() 。在所得溶液中加入
。在所得溶液中加入![]() 的NaOH溶液
的NaOH溶液![]() ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为![]() 。下列有关说法正确的是
。下列有关说法正确的是
![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]()
![]() 硝酸的物质的量浓度为
硝酸的物质的量浓度为![]()
![]() 、
、![]() 与硝酸反应后剩余
与硝酸反应后剩余![]() 为
为![]()
![]() 产生的
产生的![]() 的体积为
的体积为![]()
![]() 原混合物中Cu的质量分数为
原混合物中Cu的质量分数为![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com