
科目: 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/molS(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
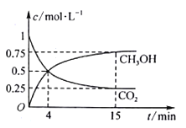
①0~4min,H2的平均反应速率v(H2)=________mol·L1·min1。
②CO2平衡时的体积分数为______________,该温度下Kp为_________kPa-2_(用含有p0的式子表示,小数点后保留1位)。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L1 | C1 | C2 |
则乙容器中反应起始向________(填“正反应”或“逆反应”)方向进行;c1_________(填“>”“<”或“=”)c2。
查看答案和解析>>
科目: 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
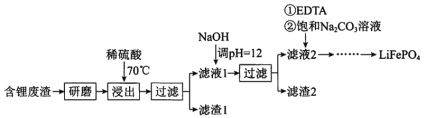
资料:i. 滤液1,滤液2中部分离子的浓度(g·L-1):

ii. EDTA能和某些二价金属离子形成稳定的水溶性络合物。
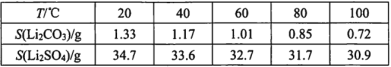
iii.某些物质的溶解度(S):
I.制备Li2CO3粗品
(1)滤渣2的主要成分有____________。
(2)向滤液2中先加入EDTA目的是:________,再加入饱和Na2CO3溶液,90℃充分反应后,分离出固体Li2CO3粗品的操作是________。
(3)处理1 kg含锂3.50%的废渣,锂的浸出率为a, Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(用a,b表示需化简,摩尔质量:Li 7g·mol-1 Li2CO3 74 g·mol-1 )
II.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是______________,该池使用了________(填“阳”或“阴”)离子交换膜。

III.制备LiFePO4
(5)将电池级Li2CO3和C、 FePO4高温下反应,共生成2种产物其中有一种为可燃性气体,该反应的化学方程式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是___杂化,CB3分子的空间构型为___。
(2)C的氢化物极易溶于水的原因是___。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:___(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压下,反应N2(g)+3H2(g) 2NH3(g)的反应热和化学平衡常数分别为△H和K,则相同温度和压强下,反应4NH3(g)2N2(g)+6H2(g)的反应热和化学平衡常数为( )
A.-2ΔH和 K-2B.-2ΔH和 K2C.2ΔH和2KD.2ΔH和K-2
查看答案和解析>>
科目: 来源: 题型:
【题目】三硫化四磷用于制造火柴等,可由白磷和单质硫化合而得。它们的结构如下:

依据下列键能数据,反应8P4(s)+3S8(s)=8P4S3(g)的ΔH为( )
化学键 | P—P | S—S | P—S |
键能/kJ·mol-1 | a | b | c |
A.24(a+b-2c) kJ·mol-1B.(32a+24b-24c) kJ·mol-1
C.(48c-24a-24b) kJ·mol-1D.(8a+3b-3c) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(1)===H2O(g) △H=+44kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为___________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①根据如图判断该反应的△H___________0(填“>”“<”或“=”),理由是___________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO)2=___________,反应的平衡常数K=______(保留三位小数)
③该反应达到平衡后,为再提高反应速率同时提高NO2的转化率,可采取的措施有______(填编号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH___________(填“增大”“减小”或“不变”),负极的电极反应式为___________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为___________;常温下将 a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈___________(填“酸”“碱”或“中”)性,溶液中c(HN3)=___________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
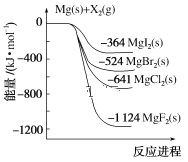
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为MgBr2(s)+Cl2(g)===MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】20世纪90年代提出的“绿色化学”为有机合成指明了方向。我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反应过程示意图如图:
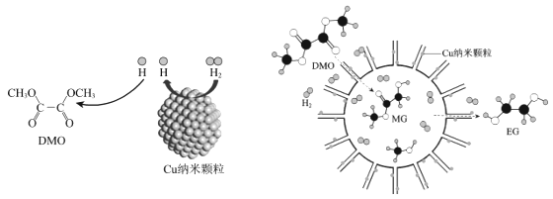
(1)MG分子中含有官能团的名称___;
(2)EG的分子式___;
(3)DMO酸性条件下水解的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓![]() 中组成原电池
中组成原电池![]() 图
图![]() ,测得原电池的电流强度
,测得原电池的电流强度![]() 随时间
随时间![]() 的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是
的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是
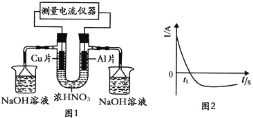
A.![]() 时刻前,Al片的电极反应为:
时刻前,Al片的电极反应为:![]()
B.![]() 时,因Al在浓硝酸中钝化,氧化膜阻碍了Al继续反应
时,因Al在浓硝酸中钝化,氧化膜阻碍了Al继续反应
C.![]() 之后,正极Cu失电子,电流方向发生改变
之后,正极Cu失电子,电流方向发生改变
D.烧杯中NaOH溶液的作用为吸收![]() ,防止污染空气
,防止污染空气
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是大气的主要污染物之一。催化还原SO2不仅可以消除SO2的污染,还可以得到工业原料S。燃煤烟气中硫的回收反应为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) △H。
2CO2(g)+S(l) △H。
(1)已知:2CO(g)+O2(g)===2CO2(g) △H1=-566.0kJ·mol-1
S(l)+O2(g)===SO2(g) △H2=-296.8 kJ·mol-1
则硫的回收反应的△H=___________ kJ·mol-1。
(2)其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图所示。260℃时,___________(填“La2O3”、“NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是___________。

(3)一定条件下,若在恒压密闭容器中发生硫的回收反应,SO2的平衡转化率与温度、压强的关系如图所示,则P1、P2、P3、P4由大到小的顺序为___________;某温度下,若在恒容密闭容器中,初始时c(CO)=2 a mol·L-1,c(SO2)= a mol·L-1,SO2的平衡转化率为80%,则该温度下反应的化学平衡常数为___________。
(4)某实验小组为探究烟气流速、温度对该反应的影响,用La2O3作催化剂,分别在两种不同烟气流量、不同温度下进行实验。实验结果显示:在260℃时,SO2的转化率随烟气流量增大而减小,其原因是___________;在380℃时,SO2的转化率随烟气流量增大而增大,其原因是___________。
(5)工业上常用Na2SO3溶液吸收烟气中的SO2,将烟气通入1.0 mol·L-1的N2SO3溶液,当溶液pH约为6时,吸收SO2的能力显著下降此时溶液中c(HSO3-)c︰(SO32-)=___________。(已知H2SO3的Ka1=1.5×10-2、Ka2=1.0×10-7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com