
科目: 来源: 题型:
【题目】(1)Cu与浓硫酸反应制备![]() 的实验探究。
的实验探究。
①写出Cu与浓硫酸反应的化学方程式:___________________________
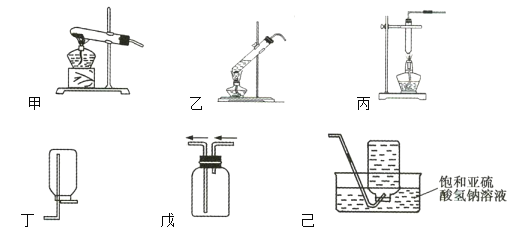
②如图所示,气体发生装置选取____________(填“甲”“乙”或“丙”),气体收集装置选取_______________________________________(填“丁”“戊”或“己”)。
(2)Zn与浓硫酸反应生成气体的实验探究。
结合实验室制备H2的反应,某实验小组猜想Zn与浓硫酸反应的气体生成物中含有H2杂质。该小组同学利用下列装置对Zn与浓硫酸反应生成的气体混合物进行实验探究:
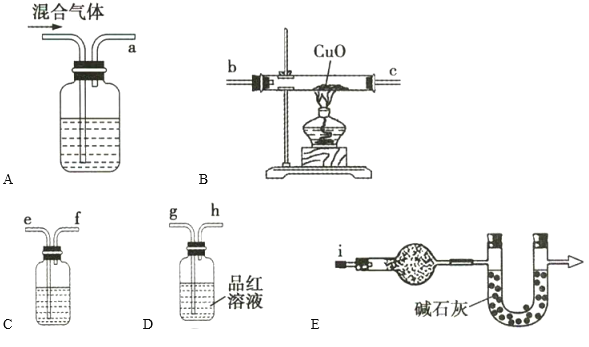
①装置的正确连接顺序为a→ ______________________________ 。
②装置A中盛有浓NaOH溶液,实验开始时,该装置中发生反应的离子方程式为______________________________。
③如果混合气体中含有足量的H2,则装置B中的现象是______________________________ 。
④装置C中盛装的试剂名称是______________________________ 。装置D的作用是______________________________ 。
⑤通过装置E的球形干燥管中盛有的试剂所产生的现象,可推断出Zn与浓硫酸反应生成的气体混合物中含有H2,该球形干燥管中盛装的试剂的化学式为______________________________,现象为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() 某地区的雾霾中可能含有如下可溶性离子:
某地区的雾霾中可能含有如下可溶性离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
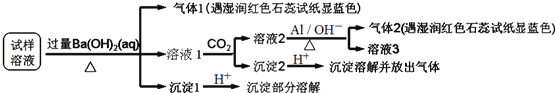
根据以上的实验操作与现象,该同学得出的结论错误的是![]()
A.试样中肯定存在![]() 、
、![]() 和
和![]() ,可能有
,可能有![]()
B.试样中不一定存在![]() 、
、![]() 、
、![]()
C.沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝
D.该雾霾中可能存在![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中只可能溶有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子中的几种离子。为分析其组成,现进行如下实验:
等离子中的几种离子。为分析其组成,现进行如下实验:
![]() 取10mL该溶液于试管中滴加足量的
取10mL该溶液于试管中滴加足量的![]() 溶液,加稀硝酸酸化后过滤得到
溶液,加稀硝酸酸化后过滤得到![]() 白色沉淀甲.
白色沉淀甲.
![]() 取上述反应后的滤液,加入
取上述反应后的滤液,加入![]() 溶液未见沉淀产生.
溶液未见沉淀产生.
![]() 另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为
另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为![]() 时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为
时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为![]() 假设丙全部逸出
假设丙全部逸出![]() ,最后沉淀完全溶解。
,最后沉淀完全溶解。
下列推断正确的是![]()
A.肯定有![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定有![]() 、
、![]() 、
、![]()
C.肯定没有![]() 、
、![]() 、
、![]()
D.肯定没有![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)![]() C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
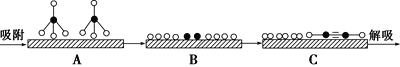
①若用![]() 和
和![]() 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
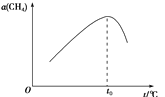
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0 ℃后CH4的转化率突减的原因可能是_______。
(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:
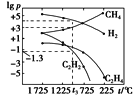
①t1 ℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
②在图中,t3 ℃时,化学反应2CH4(g)![]() C2H2(g)+3H2(g)的压强平衡常数Kp=____。
C2H2(g)+3H2(g)的压强平衡常数Kp=____。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________。
(5)设计如图实验探究牺牲阳极的阴极保护法原理:
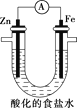
操作 | 现象 |
(i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液 | 无明显现象 |
(ii)在U形管铁极附近滴加铁氰化钾溶液 | 产生蓝色沉淀 |
得出结论:①锌______保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是____杂化,CB3分子的空间构型为____。
(2)C的氢化物极易溶于水的原因是____。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:____(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为____。
(5)X与Y所形成化合物晶体的晶胞如图所示。
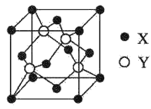
①在一个晶胞中,X离子的数目为____;
②若该化合物的密度为ag·cm-3,则晶胞的体积是____cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
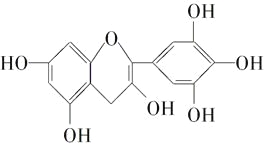
①分子式为C15H12O7
②1 mol儿茶素A在一定条件下最多能与7 molH2加成
③等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应,消耗金属钠和氢氧化钠的物质的量之比为1∶1
④1 mol儿茶素A与足量的浓溴水反应,最多消耗4 mol Br2
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,0.1 mol/L的NH4HCO3溶液pH=7.8。往碳酸的饱和水溶液中通入NH3,测得含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法错误的是 ( )
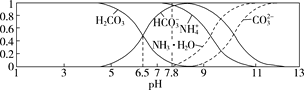
A.常温下,Kb(NH3·H2O)>Ka1(H2CO3)
B.向pH=6.5的上述溶液中通入NH3时,NH4+和HCO3-浓度都逐渐减小
C.NH4HCO3溶液中存在关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示,下列说法正确的是 ( )
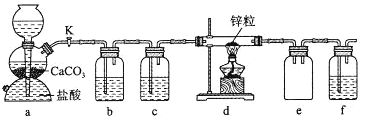
A.实验开始时,先点燃酒精灯,后打开活塞K
B.b、c、f中试剂依次为氢氧化钠溶液、浓硫酸、银氨溶液
C.a中所发生反应的离子方程式是CaCO3+2H+=CO2↑+Ca2++H2O
D.装置e的作用是收集一氧化碳气体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某温度下,水的离子积常数KW=1.0×10-12,请回答下列问题:
(1)此温度___25℃(填“>”、“<”或“=”),原因是___。
(2)对水进行下列操作,能抑制水的电离的是___。
A.通入适量SO2气体 B.加入适量Ba(OH)2溶液
C.升温至60℃ D.加入NH4Cl溶液
(3)此温度下纯水中的c(H+)=__。
(4)醋酸的下列性质中,可以证明它是弱电解质的是___。
①1mol·L-1的CH3COOH溶液中c(H+)=10-2mol·L-1
②CH3COOH可以任意比与H2O互溶
③在相同条件下,CH3COOH溶液的导电性比盐酸弱
④10mL1mol/L的CH3COOH恰好与10mL1mol/L的NaOH溶液完全反应
⑤同浓度同体积的醋酸和盐酸与Fe反应时,醋酸溶液中放出H2的速度慢
⑥醋酸溶液中CH3COOH、CH3COO-、H+同时存在
查看答案和解析>>
科目: 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为:

已知:
有关核黄素的下列说法中,不正确的是:
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com