
科目: 来源: 题型:
【题目】有图1、2所示的装置,下列叙述正确的是( )
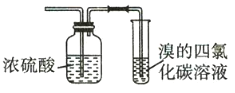
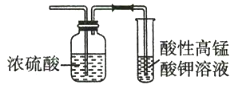
图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】在相同温度下,有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入 1 mol SO2 和 1 mol O2,乙容器中充入 2 mol SO2 和 2 mol O2。下列叙述中正确的是( )
A.平衡时 SO2 的转化率:乙<甲B.平衡时 O2 的浓度:乙<甲
C.化学反应速率:乙<甲D.平衡时 SO2 的体积分数:乙<甲
查看答案和解析>>
科目: 来源: 题型:
【题目】“五水共治”是浙江治水的成功典范,其中含氮废水处理是污水治理的一个重要课题,图3是高含氰![]() 废水处理方案:
废水处理方案:
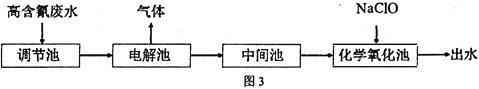
![]() 高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:
高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:![]() ,请写出第二阶段的电极反应式________。
,请写出第二阶段的电极反应式________。
![]() 电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将
电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将![]() 氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________。
氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CHCH3)的结构或性质不正确的是( )
A.能使溴水褪色
B.与HCl在一定条件下加成只得到一种产物
C.最多有7个原子在同一平面上
D.在空气中燃烧时火焰明亮并伴有黑烟
查看答案和解析>>
科目: 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.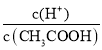 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
若该溶液升高温度,上述4种表达式的数据增大的是________。
(2)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(3)已知:25 ℃时,醋酸的电离平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________mol·L-1(用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)变为b mol·L-1,则此时c2(H+)=________(用含a、b的代数式表示)mol·L-1。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目: 来源: 题型:
【题目】表示下列变化的化学用语正确的是
A.NaHCO3溶液显碱性:HCO![]() +H2O
+H2O![]() CO
CO![]() +OH-
+OH-
B.醋酸溶液显酸性:CH3COOH=CH3COO-+H+
C.氨水显碱性:NH3·H2O![]() NH
NH![]() +OH-
+OH-
D.铁在潮湿空气中被腐蚀的负极反应:Fe-3e- =Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
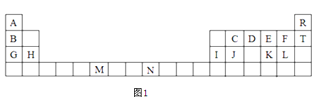
试回答下列问题:
(1)F-的结构示意图:__。
(2)D的气态氢化物的VSEPR模型为___,其中心原子的杂化类型为___,分子的空间构型为___。
(3)G、H和I的第一电离能数值由大到小的顺序为:___(用元素符号作答)。
(4)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有____(填元素符号)。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是___(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___(填分子式)。
(5)已知元素N可形成一种红紫色配合物,其组成为NCl3·5NH3·H2O。该配合物中的中心离子N离子在基态时核外简化电子排布式为___,又已知中心离子N离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是___。
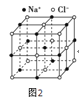
(6)过去常以JE2为催化剂的载体。JE2的晶胞可作如下推导:先将NaCl晶胞中的所有Na+去掉,并将Cl-全部换成J原子,再在每两个不共面的“小立方体”中心处各放置一个J原子便构成了晶体J的一个晶胞,则一个J的晶胞中有___个J原子,再在每两个相邻的J原子(距离最近的两个J原子)中心连线的中点处增添一个E原子,便构成了JE2晶胞,故JE2晶胞中有___个E原子。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g)
CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g)![]() CH3OH(g) △H2 ③CO2(g)+H2(g)
CH3OH(g) △H2 ③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
回答下列问题:
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C![]() O”表示CO的化学键)计算X=_______ kJ·mol-1。
O”表示CO的化学键)计算X=_______ kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为___________。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______________。(提示:从对反应速率、平衡状态、转化率角度回答)
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
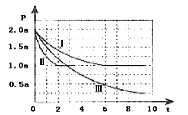
①Ⅱ和Ⅰ相比,改变的反应条件是_________;
②反应Ⅰ在6min时到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_________;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com