
科目: 来源: 题型:
【题目】标准状况下,![]() 某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为
某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为![]() ;若用足量碱石灰吸收燃烧产物,则碱石灰增重
;若用足量碱石灰吸收燃烧产物,则碱石灰增重![]() 。
。
(1)计算燃烧产物中水的质量_____________。
(2)若原气体是单一气体,通过计算推断它的分子式___________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式________________(只要求写出一组)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
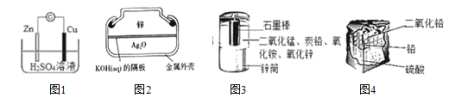
A.图 1 锌铜原电池中,Zn2+向 Cu 电极方向移动,Cu 电极附近溶液中 H+浓度增加
B.图 2 纽扣式银锌电池中,正极的电极反应式为 Ag2O+2e -+H2O = 2Ag+2OH-
C.图 3 锌锰干电池中,锌筒作负极,发生氧化反应,锌筒会变薄
D.图 4 铅蓄电池中,使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目: 来源: 题型:
【题目】一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是

A.1 mol 该物质彻底燃烧需要6 mol O2
B.三氯代物只有一种
C.该分子中所有碳原子在同一平面内
D.与其互为同分异构体,且官能团只含碳碳三键的链烃有两种
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认反应混合气体中含有乙烯和二氧化硫,装置如图所示,试回答下列问题。

(1)图中①②③④装置可盛放的试剂分别是___________________(填序号,下同)、___________________、___________________、___________________。
A.品红溶液 B.![]() 溶液 C.浓硫酸 D.酸性
溶液 C.浓硫酸 D.酸性![]() 溶液
溶液
(2)能说明二氧化硫气体存在的现象是______________________________________。
(3)使用装置②的目的是________________________,使用装置③的目的是________________________。
(4)能说明混合气体中含有乙烯的现象是____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫铁矿![]() 主要成分为
主要成分为![]() ,还有少量CuS、
,还有少量CuS、![]() 等杂质
等杂质![]() 为原料制备绿矾晶体
为原料制备绿矾晶体![]() 的工艺流程如下:
的工艺流程如下:
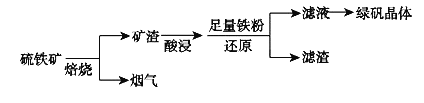
![]() “酸浸”过程,矿渣中的
“酸浸”过程,矿渣中的![]() 与稀
与稀![]() 反应的离子方程式___________________。
反应的离子方程式___________________。
![]() 烟气中的
烟气中的![]() 会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
![]() 滤液中金属阳离子的检验方法________________________________。
滤液中金属阳离子的检验方法________________________________。
![]() 溶液制备绿矾晶体过程中要保持
溶液制备绿矾晶体过程中要保持![]() 过量,理由___________________________。
过量,理由___________________________。![]() 结合化学用语说明原因
结合化学用语说明原因![]()
![]() 燃料细菌脱硫法是用氧化亚铁硫杆菌
燃料细菌脱硫法是用氧化亚铁硫杆菌![]() 对硫铁矿进行催化脱硫,同时得到
对硫铁矿进行催化脱硫,同时得到![]() 溶液。其过程如图所示:
溶液。其过程如图所示:
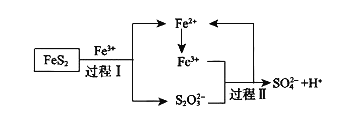
已知总反应为:![]()
![]() 将过程I离子方程式补充完整
将过程I离子方程式补充完整
____FeS2+_____Fe3++______ _______=7Fe2++________S2O32-+_____ _____
![]() 过程II反应的离子方程式___________________________________。
过程II反应的离子方程式___________________________________。
![]() 绿矾晶体在空气中易被氧化。取
绿矾晶体在空气中易被氧化。取![]() 样品,加水完全溶解,用酸化的
样品,加水完全溶解,用酸化的![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。反应原理:
。反应原理:![]() 。则绿矾晶体纯度的计算式为_______________。
。则绿矾晶体纯度的计算式为_______________。![]() 摩尔质量为
摩尔质量为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】利用双离子交换膜电解法可以处理含NH4NO3的工业废水,原理如图所示,下列叙述错误的是
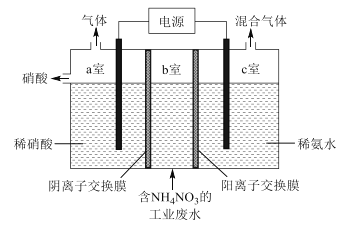
A. NH4+由b室向c室迁移
B. c室得到的混合气体是NH3和H2
C. 阳极反应式为2H2O -4e-=O2+4H+
D. 理论上外电路中流过1mol电子,可处理工业废水中0.5mol NH4NO3
查看答案和解析>>
科目: 来源: 题型:
【题目】我国学者研制了一种纳米反应器,用于催化草酸二甲醋(DMO)和氢气反应获得EG。反应过程示意图如下。

下列说法正确的是
A.氢气在该反应中作为催化剂
B.DMO分子中只有碳氧单键发生了断裂
C.MG酸性水解的一种产物在一定条件下能形成高分子化合物
D.EG和甲醇互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
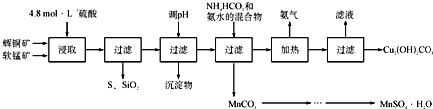
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0molL-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
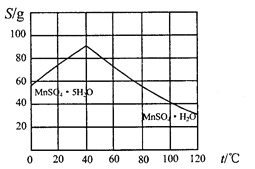
(6)用标准BaCl2溶液测定样品中MnSO4H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
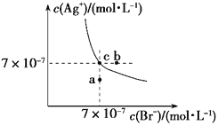
A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目: 来源: 题型:
【题目】锌的化合物在工农业生产中有广泛的应用。请回答下列问题:
(1)基态锌原子中,核外电子占据的最高能级的符号是_________。锌的熔点比铝的熔点低,原因是______________。
(2)锌冶炼过程中会产生污染性气体二氧化硫,已知液态二氧化硫可以发生类似于水的自身电离2SO2(l)![]() SO2++
SO2++![]() ,S和O两种元素中电负性较强的是_______,与SO2+互为等电子体的单质分子为_______(填化学式),SO2+中的σ键和π键数目比为______________。
,S和O两种元素中电负性较强的是_______,与SO2+互为等电子体的单质分子为_______(填化学式),SO2+中的σ键和π键数目比为______________。
(3) [Zn(CN)4]2在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O![]() [Zn(H2O)4]2++4HOCH2CN,HOCH2CN分子中碳原子轨道的杂化类型是_________,HCHO的立体构型为_______________,[Zn(CN)4]2中Zn2+与CN中的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2的结构可用示意图表示为__________________。
[Zn(H2O)4]2++4HOCH2CN,HOCH2CN分子中碳原子轨道的杂化类型是_________,HCHO的立体构型为_______________,[Zn(CN)4]2中Zn2+与CN中的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2的结构可用示意图表示为__________________。
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_________。若该晶胞密度为ρ g·cm3,硒化锌的摩尔质量为M g/mol,NA代表阿伏加德罗常数,则晶胞参数a为__________cm。
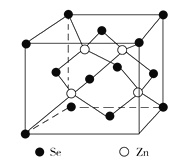
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com