
科目: 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,再与饱和食盐水反应.
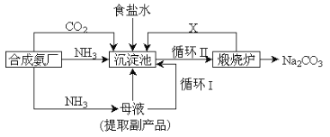
(1)该法与氨碱法比大大提高了原料利用率,主要表现在_______。
(2)碳酸氢钠分解产生的二氧化碳可循环使用,但必须要补充,补充的主要原因是_________,但实际生产中补充量超过理论上反应耗用量,可能的原因是______。
(3)氨碱法需补充的二氧化碳一定来自_________。那么联合制碱需补充的二氧化碳可能来自__________。
(4)侯德榜法在滤去碳酸氢钠的母液中通氨气并加入细小食盐颗粒,冷却析出副产品,通氨气的作用____。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
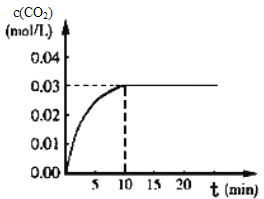
(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度
C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2)=c(H2)= 0.13mol/L,则此时正、逆反应速率的大小:υ正______________υ逆(填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)Pb(s)+C02(g) △H,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
(5)该反应的△H______________0(选填“>”、“〈”或“=”)。
(6)当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极解饱和氯化钠溶液,通电时,为使Cl2被完成吸收投篮有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液和主要成分判断正确的是( )
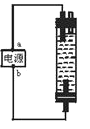
A.a为正极,b为负极:NaClO和NaCl
B.a为负极,b为正极:NaClO和NaCl
C.a为阳极,b为阴极:HClO和NaCl
D.a为阴极,b为阳极:HClO和NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述与图象相对应的是
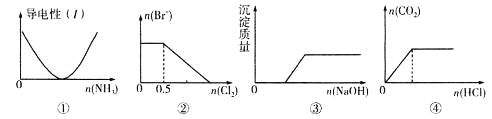
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目: 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】1892年比利时人索尔维以NaCl、CO2、NH3、H2O为原料制得了纯净的Na2CO3,该法又称氨碱法,其主要生产流程如下。完成下列填空
(1) 写出反应①中产生碳酸氢钠的离子方程式_________________________________。
(2)NaHCO3在水中溶解度较小,以沉淀形式析出,则图中③的操作名称___________________。从绿色化学原料的充分利用的角度看,该方法有明显的缺陷(答一条即可)___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1mol/LNa2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
(1)①时刻Na2SO3溶液中水的电离程度________同温下纯水中水的电离程度(填“>”、“<”或“=”);应用平衡原理解释该原因_______________________________。
(2)④的pH略小于①是由于_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是

A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com