
科目: 来源: 题型:
【题目】现有可逆反应.2NO2(g)![]() N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
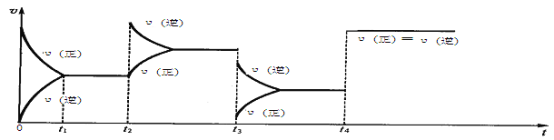
t2:_______________________________________________;
t3:_______________________________________________;
t4:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
①常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA;
②标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA;
③常温下46gNO2和N2O4混合气体中含有原子数为3NA;
④常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA;
⑤足量铁在氯气中反应,lmol铁失去的电子数为2NA;
⑥标准状况下22.4LH2中含中子数为2NA;
⑦1LImol/L的盐酸溶液中,所含氯化氢分子数为NA。
A.①④B.②⑤⑥C.③D.②④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小, Y的次外层电子数是最外层的![]() ,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
A. 原子半径:rW>rZ>rY
B. 化合物ZX中各原子均满足8电子稳定结构
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 简单气态氢化物稳定性:W>Y
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,一定不能自发进行的是( )
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS=1110 J/(mol·K)
B. CO(g)===C(s,石墨)+![]() O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=37.301kJ/mol ΔS=184.05 J/(mol·K)
查看答案和解析>>
科目: 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)H=-1648kJ/mol
C(s)+O2(g)=CO2(g)H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
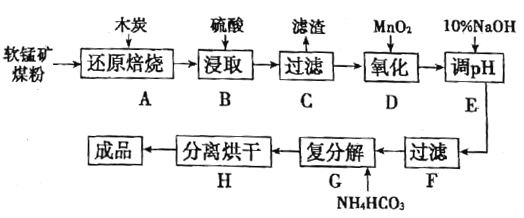
已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为__________,其目的是__________。
(4)步骤G,温度控制在35℃以下的原因是__________,若Mn2+恰好沉淀完全时测得溶液中![]() 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是__________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中![]() 完全转化为
完全转化为![]() );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应![]() +
+![]() =N2↑+2H2O以除去
=N2↑+2H2O以除去![]() ;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO
;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO![]() ;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为__________。
②试样中锰元素的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有机物F和高分子N的合成路线如图所示:

已知:RCH=CHR'![]() RCOOH+R'COOH,RCH=CHR'
RCOOH+R'COOH,RCH=CHR'![]() RCHO+R'CHO
RCHO+R'CHO
![]() 只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为
只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为![]() ,经测定Q的相对分子质量是128。
,经测定Q的相对分子质量是128。![]() 可与
可与![]() 加成,并能与
加成,并能与![]() 恰好完全反应,且分子中无支链。Q的分子式是 ______________。
恰好完全反应,且分子中无支链。Q的分子式是 ______________。
![]() 所含官能团的名称是 ___________、 _____________;
所含官能团的名称是 ___________、 _____________;![]() 的反应类型是 ________________;
的反应类型是 ________________;
![]() 写出C与银氨溶液反应的化学方程式: _______________;
写出C与银氨溶液反应的化学方程式: _______________;
![]() 的结构简式是 _______________;Q的反式结构简式是 ____________。
的结构简式是 _______________;Q的反式结构简式是 ____________。
![]() 下列说法正确的是 _________________。
下列说法正确的是 _________________。
A. C能与苯酚在一定条件下生成高分子化合物
B. D催化加氢的产物与F互为同分异构体
C. F能发生氧化反应、取代反应、加成反应
D. 高分子N的每条分子链中含有![]() 个酯基
个酯基
查看答案和解析>>
科目: 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为![]() 、
、![]() ,还含有少量的FeO、
,还含有少量的FeO、![]() 和C等。实验室模拟工业上的两种方法从粉煤灰中提取活性
和C等。实验室模拟工业上的两种方法从粉煤灰中提取活性![]() ,其流程如下:
,其流程如下:
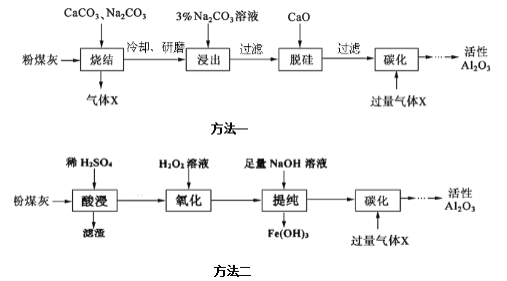
己知“烧结”过程的产物主要是:![]() 、
、![]() 、
、![]() 和
和![]() 等。
等。
![]() “烧结”过程中铝元素转化的化学方程式为__________。
“烧结”过程中铝元素转化的化学方程式为__________。
![]() “浸出”过程中,
“浸出”过程中,![]() 可完全彻底水解,水解反应的离子方程式为________。
可完全彻底水解,水解反应的离子方程式为________。
![]() 滤渣的主要成分是____________。
滤渣的主要成分是____________。
![]() “提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中
“提纯”过程中,当加入NaOH溶液使沉淀量达到最大时,溶液中![]() ______ _。
______ _。
![]() “提纯”过程中,如当
“提纯”过程中,如当![]() 时,说明溶液中
时,说明溶液中![]() 被除尽,则此时溶液中pH______。
被除尽,则此时溶液中pH______。![]() 己知
己知![]() 的
的![]()
![]() “碳化”过程中,通入过量气体X时发生反应的离子方程式为________。
“碳化”过程中,通入过量气体X时发生反应的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业。
![]() 生产制备:工业上一般以重晶石
生产制备:工业上一般以重晶石![]() 为原料,采用高温煅烧还原法;实验室一般以重晶石
为原料,采用高温煅烧还原法;实验室一般以重晶石![]() 为原料,采用沉淀转化法。
为原料,采用沉淀转化法。
高温煅烧还原法:
![]()
![]() 煅烧还原的化学方程式为:_____________。
煅烧还原的化学方程式为:_____________。
![]() 为了提高浸取速率,可采取的措施是__________
为了提高浸取速率,可采取的措施是__________![]() 任写一种
任写一种![]() 。
。
![]() 经检验BaS的水溶液呈碱性,原因是
经检验BaS的水溶液呈碱性,原因是![]() 用离子方程式表示
用离子方程式表示![]() __________。
__________。
沉淀转化法:向![]() 沉淀中加入饱和
沉淀中加入饱和![]() 溶液,充分搅拌,弃去上层清液。如此处理多次,直到
溶液,充分搅拌,弃去上层清液。如此处理多次,直到![]() 全部转化为
全部转化为![]() :
:![]() 平衡常数
平衡常数![]()
![]() 现有
现有![]() ,每次用
,每次用![]() 饱和
饱和![]() 溶液处理,假定
溶液处理,假定![]() 能全部转化,至少需要处理_____________次。
能全部转化,至少需要处理_____________次。
![]() 从“绿色化学”角度分析,用饱和
从“绿色化学”角度分析,用饱和![]() 溶液沉淀转化法的优点是:__________。
溶液沉淀转化法的优点是:__________。
![]() 分离提纯
分离提纯
某实验室分离提纯混有少量碳酸钙杂质的碳酸钡样品的步骤如下:
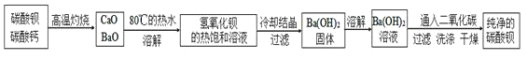
![]() 将灼烧后的固体混合物置于
将灼烧后的固体混合物置于![]() 的热水中,制成氢氧化钡的热饱和溶液。为减少
的热水中,制成氢氧化钡的热饱和溶液。为减少![]() 的损失并除去不溶物应进行的操作是_____。
的损失并除去不溶物应进行的操作是_____。
![]() 向制得的
向制得的![]() 溶液中滴加_______
溶液中滴加_______![]() 填一种试剂名称
填一种试剂名称![]() ,再通入二氧化碳。当观察到_______时,即可停止通二氧化碳。
,再通入二氧化碳。当观察到_______时,即可停止通二氧化碳。
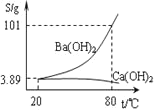
![]() 环境监测
环境监测
![]() 环境监测某工厂废水中
环境监测某工厂废水中![]() 的浓度。取废水
的浓度。取废水![]() ,控制适当的酸度加入足量的
,控制适当的酸度加入足量的![]() 溶液,得
溶液,得![]() 沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时
沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时![]() 全部转化为
全部转化为![]() ,再加入过量KI溶液,反应液中再滴加
,再加入过量KI溶液,反应液中再滴加![]() 溶液,反应完全时,消耗
溶液,反应完全时,消耗![]() 溶液
溶液![]() 。已知有关的离子方程式为:
。已知有关的离子方程式为:![]() ;
;![]() 。
。
该工厂废水中![]() 的物质的量浓度__________
的物质的量浓度__________![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列能用勒夏特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的(合成氨是放热反应)
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com