
科目: 来源: 题型:
【题目】已知苯甲酸的酸性比碳酸强,苯酚的酸性比碳酸弱。则可将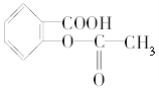 转变为
转变为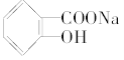 的方法是( )
的方法是( )
①与足量的NaOH溶液共热,再通入CO2 ②与稀硫酸共热后,加入足量的NaOH溶液 ③加热溶液,通入足量的SO2 ④与稀H2SO4共热后,加入足量的NaHCO3
A.①②
B.①④
C.②③
D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是______________________________________________。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
① 针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
Ⅰ. 根据白色沉淀B是__________________(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ. 仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:_______________________________________________________。
Ⅲ. 向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是________________(填化学式)。
根据以上实验,证明A仅为CuSCN。
② 进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_______Cu2+ + _______SCN![]() = _______CuSCN↓ + _______ (SCN)2
= _______CuSCN↓ + _______ (SCN)2
③ 结合上述过程以及Fe(SCN)3 Fe3+ + 3SCN![]() 的平衡,分析(2)中溶液红色褪去的原因:_________________。
的平衡,分析(2)中溶液红色褪去的原因:_________________。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I![]() = H2O + IO
= H2O + IO![]() ;H2O2 + IO
;H2O2 + IO![]() = H2O + O2↑+ I
= H2O + O2↑+ I![]() 。总反应的化学方程式是_______________________________________________。
。总反应的化学方程式是_______________________________________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______(填字母)。
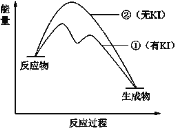
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I![]() = H2O + IO
= H2O + IO![]() 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________。
(4)资料4:I![]() + I
+ I![]()
![]() I
I![]() K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I | I | I |
浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
① a =____________________。
② 该平衡体系中除了含有I![]() 、I
、I![]() 和I
和I![]() 外,一定还含有其他含碘微粒,理由是_____________________。
外,一定还含有其他含碘微粒,理由是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________。
Ⅱ.上述反应适宜的温度范围是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________、_________和2Al + N2 ![]() 2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
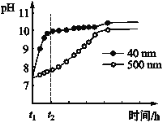
① AlN粉末水解的化学方程式是____________________________________。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
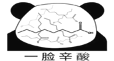
A.7种B.11种C.16种D.17种
查看答案和解析>>
科目: 来源: 题型:
【题目】一些常见有机物的转化如图下列说法正确的是( )
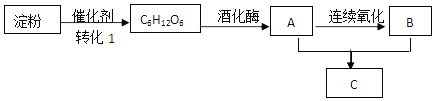
A.上述有机物中只有C6H12O6属于糖类物质
B.转化1可在人体内完成,该催化剂属于蛋白质
C.物质C和油脂类物质互为同系物
D.物质A和B都属于电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,取一定量冰醋酸,进行如下实验:
① 将冰醋酸配制成0.1 mol·L-1醋酸溶液;
② 取20 mL①所配溶液,加入a mL 0.1 mol·L-1 NaOH溶液,充分反应后,测得溶液pH=7;
③ 向②所得溶液中继续滴加稀盐酸,直至溶液中n(Na+) = n(Cl-)。
下列说法正确的是
A.①中:所得溶液的pH=1
B.②中:a=20
C.③中:所得溶液中c(CH3COO-)<c(H+),且pH<7
D.①与③所得溶液相比,等体积时所含CH3COOH分子数目相等
查看答案和解析>>
科目: 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发牛了巨大变化。
![]() 古代中国四大发明之一的指南针是由大然磁石制成的,其主要成分是______
古代中国四大发明之一的指南针是由大然磁石制成的,其主要成分是______![]() 填字母序号
填字母序号![]() 。
。
![]()
![]()
![]()
![]()
![]() 硫酸渣的主要化学成分为:
硫酸渣的主要化学成分为:![]() 约
约![]() ,
,![]() 约
约![]() ,
,![]() 约
约![]() ,MgO约
,MgO约![]() 用该废渣制取药用辅料一红氧化铁的上艺流程如下
用该废渣制取药用辅料一红氧化铁的上艺流程如下![]() 部分操作和条件略
部分操作和条件略![]() :
:
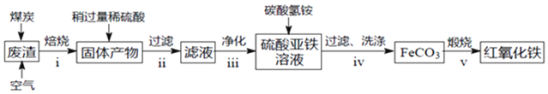 回答下列问题:
回答下列问题:
![]() 在步骤i中产生的有毒气体可能有______。
在步骤i中产生的有毒气体可能有______。
![]() 在步骤ii操作中,要除去的离子之一为
在步骤ii操作中,要除去的离子之一为![]() 若常温时
若常温时![]() ,此时理论上将
,此时理论上将![]() 沉淀完全,则溶液的pH为______。
沉淀完全,则溶液的pH为______。
![]() 步骤iv中,生成
步骤iv中,生成![]() 的离子方程式是______。
的离子方程式是______。
![]() 氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式______。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:______。
氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式______。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:______。
![]() 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是______。
![]() 如今基于普鲁士蓝合成原理可检测食品中
如今基于普鲁士蓝合成原理可检测食品中![]() ,方案如下:
,方案如下:
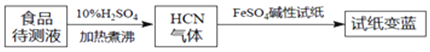
若试纸变蓝则证明食品中含有![]() ,请解释检测的原理:______。
,请解释检测的原理:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g) ![]() 2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )
2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )
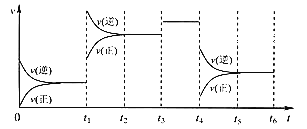
A. t1时升高了温度 B. t3时加入了催化剂
C. t4时降低了压强 D. 在t3~t4时间内,X的体积分数最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com