
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向氨水中通入过量SO2:NH3·H2O+SO2===NH4++HSO3-
B. Si与NaOH溶液反应:Si+2OH-+H2O===SiO32-+H2↑
C. 电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D. Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:
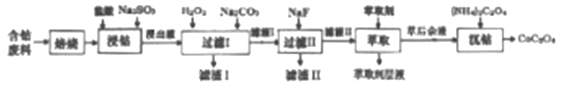
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
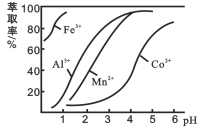
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。
(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·2H2O]主要用作磷化剂;以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
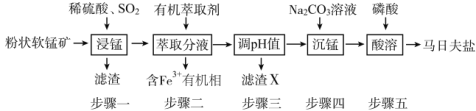
(1)按照无机物命名规律,马日夫盐[Mn(H2PO4)2·2H2O的化学名称为___。
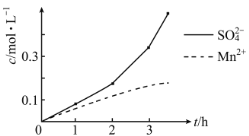
(2)步骤一中,MnO2被SO2和___还原。若SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,科研人员认为Mn2+对O2与H2SO3反应起催化作用,其理由是__。
(3)滤渣X主要成分为___;步骤三调节pH时,最适宜加入的物质是__。
A.过量稀盐酸 B.适量Na2CO3溶液
C.适量磷酸溶液 D.过量CaCO3
(4)在沉锰过程中,应将Na2CO3溶液逐量加入锰盐溶液中,如果颠倒试剂混合顺序会有Mn(OH)2生成,其原因是Na2CO3溶液具有较强__性;步骤五产生马日夫盐晶体的化学反应方程式为__。
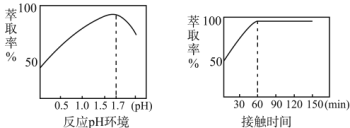
(5)Fe3+的萃取率与溶液的pH和接触时间之间的关系如图,据此分析,萃取的最佳条件为____。
(6)马日夫盐作防锈磷化剂的原因是利用其较强的酸性以及在防锈处理过程中生成了具有保护作用的FeHPO4,马日夫盐显酸性的主要原因是__(用相关化学用语回答)。
查看答案和解析>>
科目: 来源: 题型:
【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6 | B12结构单元 |
结构模型示意图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | 熔点1873 K |
A. HCN的结构式为H—C≡N,分子中“C≡N”键含有1个σ键和2个π键
B. 固态硫S8属于原子晶体,分子中S原子采用sp3杂化
C. SF6是由极性键构成的非极性分子,分子构型为八面体型
D. 单质硼属于原子晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲同学设计的证明CO具有还原性的实验装置。回答下列问题:
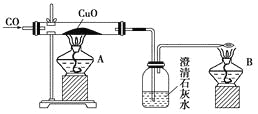
(1)实验时应先点燃________(填“A”或“B”)处的酒精灯。
(2)洗气瓶中的现象为__________________________________________________________。
(3)酒精灯B的作用是_________________________________________________________。
(4)乙同学提出甲设计太复杂,可将酒精灯合二为一,去掉B而将尾气导管口旋转到A的火焰上即可,乙同学设计是否合理?________;理由是______________________________。
(5)丙同学质疑CO能否使石灰水变浑浊,因此其设计在CO通入CuO之前应先通过澄清石灰水以排除CO与澄清石灰水反应,试对此做出评价,你认为丙的设计________(填“必要”或“不必要”),理由是____________________________________________。
(6)丁同学认为甲设计的装置中尾气处理还可以用其他方法,请你为丁同学设计一种合理的尾气处理方法:________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为 或
或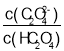 ]与pH的变化关系如图所示。下列说法一定正确的是
]与pH的变化关系如图所示。下列说法一定正确的是

A.Ⅰ表示lg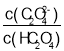 与pH的变化关系
与pH的变化关系
B.pH=1.22的溶液中:2c(C2O42—)+c(HC2O4—)>c(Na+)
C.1.22<pH<4.19的溶液中:c(HC2O4—)>c(C2O42—)>c(H2C2O4)
D.pH=4.19的溶液中:c(Na+)=3c(HC2O4—)
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
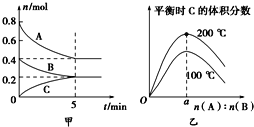
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛(苯甲醛),下列说法正确的是( )
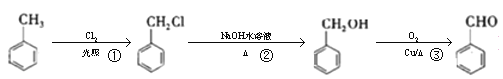
A.![]() 可以作为萃取剂萃取溴水中的溴单质
可以作为萃取剂萃取溴水中的溴单质
B.反应①②③的反应类型相同
C.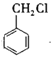 的同分异构体有3种
的同分异构体有3种
D. 和
和![]() 可以通过酸性高锰酸钾鉴别
可以通过酸性高锰酸钾鉴别
查看答案和解析>>
科目: 来源: 题型:
【题目】“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:

己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
Ksp | 6×10-36 | 3×10-19 | ||||
pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
沉淀完全 | 6.7 | 9.2 | 3.2 | |||
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com