
科目: 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域应用广泛。下图是利用乙酰丙酸(![]() )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):

已知:![]()
![]() ,(R、R′表示烃基)
,(R、R′表示烃基)
(1)A中含有的官能团是_______________(填官能团名称)。
(2)B与D的反应类型为_______________,B的结构简式为______________________
(3)C生成D的反应化学方程式为______________________。
(4)C分子的核磁共振氢谱中有_________个吸收峰;同时符合下列要求的C的同分异构体有_______种。①能发生银镜反应 ②能与NaHCO3溶液反应 ③遇FeCl3溶液显紫色
F与C属于官能团异构的同分异构体,且只含一种官能团,则1mol F与足量NaOH溶液反应时消耗NaOH的物质的量为_____________
(5)根据合成聚芳酯E的路线,请你以苯酚及2-丙醇为原料(无机试剂任选),设计合成G: 的路线。___________
的路线。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。回答下列有关问题:
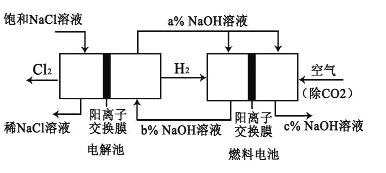
(1)电解池的阴极反应式为_____________。
(2)通入空气一极的电极反应式为_____________。燃料电池中阳离子的移动方向是_____________ (“从左向右”或“从右向左”)。
(3)电解池中产生 2molCl2,理论上燃料电池中消耗标准状况下_____________LO2。
(4) a、b、c 由大到小的顺序为:_____________。
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由 KClO3在H2SO4存在下与 Na2SO3反应制得。请写出反应的离子方程式_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
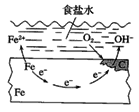
A. 铁片里的铁和碳与食盐水形成无数的微小原电池
B. 铁电极发生氧化反应
C. 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D. 放置一段时间后,铁片上有铁锈出现
查看答案和解析>>
科目: 来源: 题型:
【题目】某电动汽车使用的是高铁电池,其反应为![]()
![]()
![]() ,下列说法正确的是
,下列说法正确的是
A.放电时,若有6mol电子发生转移,则有![]() 被氧化
被氧化
B.放电时,正极反应为:![]()
C.充电时,电池的负极与外接电源的负极相连
D.充电时,阴极附近溶液的pH变小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中前四周期的元素,它们的原子序数依次增大。A是宇宙中含量最丰富的元素,B、D原子的L层有2个未成对电子。E3+离子M层3d轨道电子为半满状态,F比E原子序数大1且位于同一族,G的最外层只有1个电子。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出E的电子排布式____________,E位于周期表____区。
(2)B、C、D的第一电离能由小到大的顺序为___________。
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是_________(填结构简式)
(4)![]() 的空间构型为___________,键角为_______。
的空间构型为___________,键角为_______。
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4往其溶液中加BaCl2溶液时,现象是_______;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则第二种配合物的化学式为_______
(6)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞中平均含有___个B原子。若晶胞的棱长为acm,则它的密度为____g/cm3(NA表示阿伏加德罗常数)
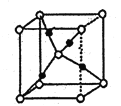
(7)G的一种氧化物M的晶胞结构如图所示(小圆圈代表氧原子),则M的化学式为________,该晶体中氧原子的配位数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关元素W、X、Y、Z的信息如下,请用化学用语完成下列问题:
元素 | 信息 |
W | 所在主族序数与所在周期序数之差为4,其单质在常温下呈黄绿色 |
X | X+的电子层结构与Ne相同 |
Y | 生活中常见的金属,其制品在潮湿的空气中会生锈 |
Z | 地壳中含量最多的金属元素 |
(1)请写出Z元素在周期表中的位置________。请写出Z高价氧化物的水化物与X最高价氧化物水化物反应的离子方程式________。
(2)X在空气中加热,生成一种淡黄色固体,该固体的电子式是________。
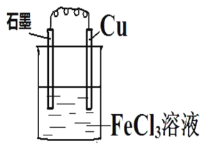
(3)以铜棒、石墨为电极材料,YW3溶液为电解质溶液,形成如图所示的原电池,则该原电池正极的电极反应式为________。如何检验正极反应的产物离子,请简述操作过程及现象________,________。
(4)Y和Z单质混合物质量为3.28g,总物质的量为0.1mol。加入足量盐酸溶解,再加入适量H2O2溶液,然后加入氨水恰好完全沉淀,过滤、洗涤、干燥,得到固体的质量为________g。加入H2O2溶液反应的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是______,这三种化台物中N原子的杂化类型是______,分子的空间构型是______
(2)N、F、Br三种元素的电负性由大到小顺序为____________
(3)叠氮酸(HN3)是一种弱酸。可部分电离出H+和N3-,请写出两种与N3-互为等电子体的分子______
(4)Fe2+、Cu2+、Co3+等过渡金属离子都能与叠氮化物、氰化物形成配合物。Fe2+的核外电子排布式为______;配合物[Co(N3)(NH3)5]SO4中Co的配位数为______,Co3+与NH3之间的作用力是______
(5)NaN3与KN3相比,NaN3的晶格能______KN3的晶格能(填“>”、“=”或“<”)+
(6)某元素X与N形成的氮化物中,X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示,X+的符号是______,晶体中每个N3-与其距离最近的X+有______个。
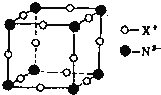
查看答案和解析>>
科目: 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
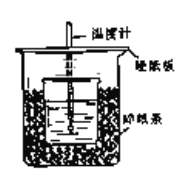
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________;由图可知该装置有不妥之处,应如何改正?___________________________________________________.
(2)烧杯间填满碎塑料泡沫的作用是__________________________________________.
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值___________(填“相等、不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com