
科目: 来源: 题型:
【题目】短周期主族元素 A、B、C、D 的原子序数依次增大,A、B、C 原子的最外层电子数之和为 12,B、C、D 位于同一周期,C 原子的最外层电子数既是 A 原子内层电子数的 3 倍又是 B 原子最外层电子数的 3 倍。下列说法正确的是( )
A.元素 A、C 的最高价氧化物对应的水化物的酸性:A>C
B.元素B 能与 A 的最高价氧化物发生置换反应
C.AC2 空间构型为角形
D.C2D2 是共价化合物,且为直线型非极性分子
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。

①电极X的材料是_________________;
②外电路中的电子是从___电极流向__电极(填电极材料名称或符号)。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是___________(填离子符号)。
(2)①金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈。请写出铁锅生锈过程的正极反应式:____________________。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用__________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的____极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+ Fe + 2H2O![]() Fe(OH)2+ Ni(OH)2。
Fe(OH)2+ Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是__(填序号)。
A.NiO2B.Fe C.Fe(OH)2D.Ni(OH)2
②该电池放电时,正极附近溶液的pH________(填增大、减小、不变)
③充电时该电池阳极的电极反应式___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的合成对国家工业发展有着举足轻重的作用,N2(g)+3H2(g) ![]() 2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
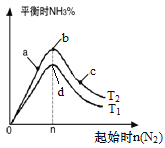
A.图中T2和T1的关系是:T2<T1
B.在a、b、c三点所处的平衡状态中,反应物H2的转化率最高的是b
C.在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大
D.反应体系中活化分子的百分含量d>b
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
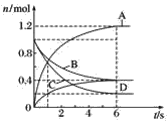
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】过渡金属钯催化的偶联反应是近年来有机合成的热点之一,如反应①:

化合物II可由以下合成路线获得:
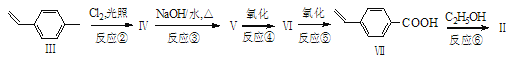
(1)化合物I所含官能团的名称为______________,化合物II的分子式为_____________。
(2)化合物IV的结构简式为______________________,某同学设想无需经反应②、③、④和⑤,直接用酸性KMnO4溶液就可将化合物III氧化为化合物VII,该设想明显不合理,其理由是__________________________________________________________。
(3)化合物VII有多种同分异构体,请写出一种符合下列要求的结构简式____________。
i)苯环上有两个取代基
ii)1 mol 该物质发生银镜反应能生成4 mol Ag
(4)反应⑥的化学方程式为________________________________________。(注明条件)
(5)化合物![]() 与化合物
与化合物![]() 在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式________________________________。
在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组为了探究SO2的实验室制法和有关化学性质,设计了如下的实验。
实验I:
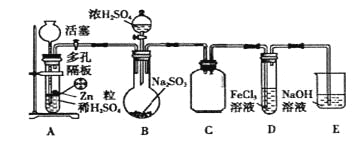
(1)实验基本操作
①多孔隔板与活塞相配合,能起到的作用是_____________________________________.
②该实验制H2时需用浓硫酸配制480mL 3 mol/L的稀硫酸,配制中所需的玻璃仪器有250 mL烧杯、l 00mL量筒、玻璃棒、胶头滴管等,还需_______________________.
③该实验过程中H2所起的作用是_____________________________.
(2)实验时先打开活塞,让装置A内试剂反应一段时间后,关闭活塞,再往装置B中滴入适量浓硫酸反应片刻后,甲、乙两学生分别取装置D中少量溶液,甲学生往其中加入酸性KMnO4溶液,观察到酸性KMnO4溶液紫红色褪去;乙学生往其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成。根据各自实验现象甲、乙学生得出SO2被Fe3+氧化。
①试判断甲、乙学生的结论是否严谨________________(填写选项)。
A.甲学生严谨 B.乙学生严谨 C.甲、乙学生都不严谨
②写出SO2被Fe3+氧化的离子反应方程式_____________________________________.
实验II:
(3)该研究小组为测定SO2催化氧化为SO3的转化率,又设计了如下实验:已知SO3熔点为16.8℃,且忽略空气中CO2的影响).
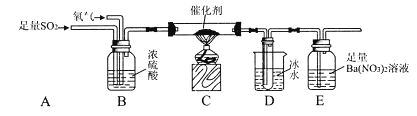
①当停止通入SO2,熄灭酒精灯后,需要继续通入氧气,其目的是:____________________.
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是_______________(用含字母的代数式表示,不用化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性K MnO4溶液进行检验,请分析方案是否合理,并说明理由:_____________________________。
(4)过程①制取FeCl3固体的具体操作步骤是_____________________________________________________。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于_______{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①RNH2+R’CH2Cl![]() RNHCH2R’+HCl(R和R’代表烃基)
RNHCH2R’+HCl(R和R’代表烃基)
②苯的同系物能被高锰酸钾氧化,如:![]()
![]()
![]()
③![]()
![]()
![]() (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
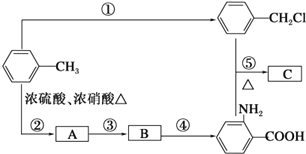
请回答下列问题:
(1)B物质的结构简式是 ______。
(2)写出反应①、②的化学方程式:
①______________;
②______________。
(3)反应①~⑤中,属于取代反应的是______(填反应序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来,其装置如图乙所示,ab间充有固体电解质Y2O3-Na2O,允许O2-自由移动。下列叙述正确的是
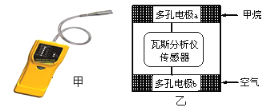
A.瓦斯分析仪工作时,电池内电路中, O2-由电极a流向电极b
B.电池外电路中电子由正极流向负极
C.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com